Forskningslaboratoriesimulator fuldfører væsentligt lægemiddelopdagelsesarbejde på få dage

John Wise. Kredit:Southern Methodist University, Hillsman S. Jackson
SMU-forskere har udviklet et sæt computerdrevne rutiner, der kan efterligne kemiske reaktioner i et laboratorium, at reducere den tid og de arbejdsrelaterede udgifter, der ofte kræves for at finde det bedst mulige lægemiddel til et ønsket resultat.
Universitetet har anmeldt patent på beregningsrutinerne under navnet ChemGen. Ud over at fremskynde processen med at finde succesfulde lægemidler til specifikke applikationer, ChemGen vil give mindre laboratorier mulighed for at bidrage til meningsfuld forskning på et niveau, som mange i øjeblikket ikke har råd til.
"ChemGen har evnen til at erstatte et team af 20 højt kvalificerede organiske kemikere i optimering af et molekyle af interesse, " sagde hovedopfinderen John Wise, en SMU-professor med speciale i strukturel biokemi. "Vi bevæbner dybest set en hær af mindre laboratorier til at lave virkelig sofistikeret forskning.
"Jeg håber også, at store lægemiddelvirksomheder drager fordel af denne teknologi, også, "Sagde Wise. ChemGen kan potentielt give en bygning fuld af dygtige kemikere mulighed for dramatisk at øge deres produktivitet fra at arbejde med så få som seks problemer om året til så mange som 60, han sagde.
"Det vil få nye lægemidler til at komme hurtigere og billigere, hvilket er præcis, hvad vi har brug for til coronavirus, og hvad der nu kommer, " sagde Wise.
I øjeblikket, det kan tage 12 til 15 år for et nyt lægemiddel at arbejde sig igennem designet, udvikling, test- og godkendelsesproces til brug hos patienter. Og mens de gennemsnitlige omkostninger ved lægemiddeludvikling for producenter er genstand for debat, anslår, at det koster så højt som 2,6 milliarder dollars.
Hvordan det virker
ChemGen fremskynder en tidlig del af lægemiddelopdagelsesprocessen kendt som farmakologisk optimering - hvilket gør stoffet funktionelt og effektivt til specifikke applikationer - en opgave, der kan tage måneder for et team af organiske kemikere at udføre. ChemGen kan udføre de samme opgaver stort set på få dage ved hjælp af højtydende computere som SMU's mammut ManeFrame II.
Wise forklarer, at det første skridt i at skabe et lægemiddel er at identificere et molekylært mål, som lægemidlet kan virke på - et mål, der spiller en rolle i at tillade en person at blive inficeret med en virus, at mærke symptomer på en sygdom eller at lide anden skade på kroppen. Når først dette mål er identificeret, næste skridt er at finde så mange kemiske nøgler som muligt, der potentielt kan blokere målets funktion og forhindre de negative biologiske effekter, der forårsager sygdom og sygdom. Både de molekylære mål og de kemiske nøgler, der virker på dem, har tendens til at være ekstremt komplekse molekyler, ansvarlig for en række opgaver i den menneskelige krop.
"De er som mennesker, " sagde Wise. "De er alle forskellige."
"Når et lægemiddelfirma finder et lægemiddelhit - en kemisk 'nøgle', som de mener kunne være værdifuld - kan de få et team af meget dygtige kemikere til at arbejde på det ene målrettede molekyle. Det er ikke det eneste molekyle, de vil arbejde med, men de bruger måske tre måneder af det næste år på at lave 1, 000 variationer af det ene molekyle, "Sagde klogt.
Dette er den traditionelle tilgang til farmakologisk optimering - kemikere forsøger at afgøre, om der er et bedre match til målproteinet end det, de lige fandt. Årsagen til det er vigtigt, at hvis et lægemiddel ikke passer perfekt til proteinet, det vil ikke binde tæt nok til det protein til at være effektivt. Forskere skal også identificere, hvilke andre proteiner i den menneskelige krop utilsigtet kan blive blokeret af den samme nøgle, muligvis forårsage bivirkninger.
ChemGen skaber molekylære varianter af den originale kemiske nøgle beregningsmæssigt i stedet for i et fysikalsk kemilaboratorium. Det efterligner, hvad der ville ske under forskellige kombinationer af omstændigheder.
"Vi lærte ChemGen reglerne for kemi for disse reaktioner - hvad der kan gøres, og hvad der ikke kan gøres, " sagde Wise, lektor i SMU Institut for Biologiske Videnskaber. "Vi kan tage tusinde forbindelser, reager dem i computeren, og lav 1, 000 produkter fra det. Så kan vi tage den gruppe på 1, 000 og reagere dem med en anden gruppe på 1, 000 andre molekyler til at skabe en million forskellige, men relaterede produkter. Dette genererer en enorm mængde kemisk varians for et givet molekyle."
Som resultat, ChemGen kan se på disse varianter og afgøre, om nogen af dem passer bedre til det målrettede protein end den originale nøgle.
"Processen er blind. Der er ingen bias. Den genererer disse varianter, og siger så bare, "Hvor passer du godt, og det rangerer, " sagde Wise. "Så en forskergruppe eller medicinalvirksomhed behøver kun rent faktisk at syntetisere molekylerne med de bedste chancer for at blive forbedret, efterlader de tusindvis af uforbedrede molekyler i computeren og ikke på laboratoriebænken.
"Denne tilgang er meget effektiv i både tid og penge, " sagde Wise. "Det begrænser spild og gør det mere sandsynligt, at det nye lægemiddel vil være bedre end det, der oprindeligt blev opdaget."
Wise har arbejdet i mere end et årti med andre SMU-forskere, herunder studerende, at udvikle det, der blev ChemGen.
Wise fik ideen til at skabe ChemGen, mens han og Pia Vogel forsøgte at finde forbindelser, der kan vende kemoterapisvigt i aggressive kræftformer. Vogel er professor og direktør for SMU's Center for Drug Discovery, Design og levering.
Alex Lippert, lektor i kemi, hjalp Wise-programmet ChemGen med at vide, hvad det kunne og ikke kunne gøre i en kemisk reaktion. Lippert og hans ph.d. studerende Maha Aljowni syntetiserede også fysisk lægemiddelforbindelserne forudsagt af ChemGen og viste, at det nøjagtigt forudsagde nye molekyler, der kunne være aktive i multi-lægemiddelresistenskræft.
Robert Kalescky tog scriptene Wise skrev og konverterede dem til et andet programmeringssprog, så ChemGen virker hurtigere og kan bruges af alle. Kalescky er SMU's HPC Applications Scientist, der bistår forskningsmiljøet på SMU med deres brug af ManeFrame II.
Amila K. Nanayakkara, Mike Chen, Maisa Correa de Oliveira og Lauren Ammerman - som alle var eller er studerende i Biologiske Videnskaber Ph.D. program på SMU - hjalp også med at teste det. Ketetha Olengue hjalp også i den tidlige forskning, da hun var bachelor på SMU.
 Varme artikler
Varme artikler
-
 Kulfibre fra grønne prækursorer og optimerede processerKredit:fabiodevilla, Shutterstock Smarte materialer svarer på sammensatte komponenter for at tilbyde række af ønskede egenskaber, alligevel har de nuværende fremstillingsprocesser på nogle måder i
Kulfibre fra grønne prækursorer og optimerede processerKredit:fabiodevilla, Shutterstock Smarte materialer svarer på sammensatte komponenter for at tilbyde række af ønskede egenskaber, alligevel har de nuværende fremstillingsprocesser på nogle måder i -
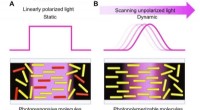 Fotopolymerisationsudløst molekylær bevægelse til fleksibelt flydende krystaldisplayA repræsenterer den molekylære justering gennem konventionelle fotojusteringsmetoder. B repræsenterer den molekylære justering opnået gennem den aktuelt rapporterede scanningsbølgefotopolymeriseringsm
Fotopolymerisationsudløst molekylær bevægelse til fleksibelt flydende krystaldisplayA repræsenterer den molekylære justering gennem konventionelle fotojusteringsmetoder. B repræsenterer den molekylære justering opnået gennem den aktuelt rapporterede scanningsbølgefotopolymeriseringsm -
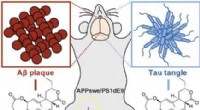 Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo -
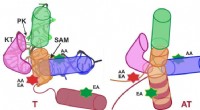 Hvordan molekylære riboswitches virker i bakterierSkematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT Mange bakterier har molekylære
Hvordan molekylære riboswitches virker i bakterierSkematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT Mange bakterier har molekylære
- Modificeret enzym kan øge anden generations ethanolproduktion
- Sælgere på websteder med rubrikannoncer favoriserer købere fra velhavende kvarterer
- Forskere arbejder på et periodisk system for økologi
- Gåsimuleringsspil signalerer en ny litterær genre
- Storbritannien skal være mere proaktiv i forhold til at tackle klimaændringer
- Aluminiumskomplekser identificeret via vibrationsfingeraftryk


