Brug af fager til at opdage nye frostvæskeproteiner
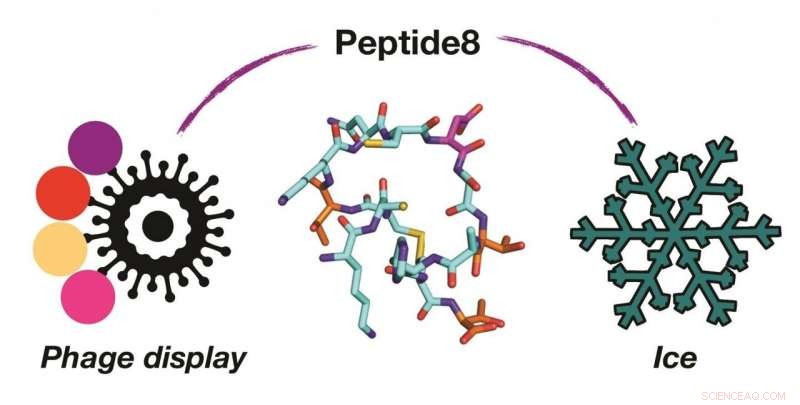
Brug af vira (fagdisplay) til at identificere det ene molekyle i en milliard (peptid8), der styrer dannelsen af is. Kredit:University of Warwick
Kontrollere, og afbødning af virkningerne af isvækst er afgørende for at beskytte infrastrukturen, hjælper med at bevare frosne celler og forbedre teksturen af frosne fødevarer. Et internationalt samarbejde mellem Warwick-forskere, der arbejder med forskere fra Schweiz, har brugt en fagudstillingsplatform til at opdage nye, lille, peptider, der fungerer som større frostvæskeproteiner. Dette præsenterer en vej til nye, lettere at syntetisere, kryobeskyttelsesmidler. Billedtekst:Brug af vira (fag-visning) til at identificere det ene molekyle i en milliard (peptid8), der styrer dannelsen af is.
Isbindende proteiner, som inkluderer frostvæskeproteiner, produceres af en lang række arter fra fisk, til insekter til planter, for at forhindre skader forårsaget af is. Proteinerne opnår den bemærkelsesværdige funktion at genkende og binde sig til is, selv i det enorme overskud af vand (som is er den faste form af). Nye frostvæskeproteiner er typisk blevet opdaget ved isolering fra organismerne.
I dette arbejde, holdet tog en meget anderledes tilgang ved at screene milliarder af mulige peptider for at finde dem, der kunne binde til is. Dette blev opnået af Phage Display - en teknologi, hvorved en virus bruges til at generere et stort antal peptider, og dem, der 'binder' til isen, kan isoleres.
Ved at bruge dette blev et cyklisk peptid på kun 14 aminosyrer (som er meget kort sammenlignet med et typisk protein) opdaget, som kunne binde til is. Holdet brugte computersimuleringer til at forstå, hvordan peptidet binder til isen, hvilket ikke er muligt med 'våde' eksperimentelle teknikker alene. Holdet viste også, hvordan dette korte peptid kan bruges til at hjælpe med at rense andre proteiner ved ace-affinitetsoprensning.
Ved at identificere disse korte peptider, det betyder, at forskere nu simpelthen kan lave (eller købe) modificerede peptider for at forstå og undersøge, hvordan disse interagerer med is og hjælpe med at designe nye kryobeskyttelsesmidler med forenklede strukturer, og dermed lavere omkostninger.
I papiret "A Minimalistic Cyclic Ice-Binding Peptide from Phage Display", udgivet i Naturkommunikation det internationale hold inklusive University of Warwick og ledet af EPFL, Schweiz, har demonstreret brugen af fag-display til at opdage nye minimalistiske frostvæskepeptider, som ikke kunne opnås med konventionelle værktøjer, hvilket ikke ville tillade de milliarder af potentielle strukturer at blive screenet.
Dr. Gabriele Sosso, assisterende professor ved University of Warwick, i Kemisk Institut kommenterer:"Dette arbejde fremhæver, at selv meget små ændringer i strukturen af disse peptider kan gøre en enorm forskel i deres evne til at kontrollere dannelsen af is. Vores computersimuleringer gjorde det muligt for os at identificere og forstå vigtigheden af disse strukturelle ændringer - hvilket er et vigtigt skridt i retning af det rationelle design af syntetiske kryobeskyttelsesmidler.
"Det er sådan et privilegium at kunne udnytte både Gibson's-gruppens eksperimentelle arbejde og SCRTP's beregningsressourcer. Sandelig, Warwick er et fantastisk sted at være, hvis du vil forstå, hvordan is dannes, og hvad kan vi gøre for at have indflydelse på denne proces."
Professor Matthew Gibson, Professor ved University of Warwick i Department of Chemistry og Warwick Medical School tilføjer:"Vi har arbejdet på at udvikle syntetiske værktøjer til at forstå, og forstyrre, isvækstprocesser med det formål at hjælpe med at udvikle nye kryobeskyttelsesmidler. Dette arbejde var virkelig spændende, da vi brugte bioteknologiske værktøjer (fag) til at opdage små, cyklisk, peptider, som er bemærkelsesværdigt potente.
"Disse peptider er nemme at syntetisere og modificere og vil accelerere vores forskning på dette område. Det fremhæver også det voksende 'team ice' samarbejdsnetværk i Warwick, kombinere eksperimentelle og beregningsstudier sammen. Vi er også taknemmelige for støtten fra IAS i Warwick, hvilket gjorde det muligt for Dr. Stevens at besøge os for at fuldføre dette arbejde, viser behovet for at støtte internationale videnskabelige samarbejder."
 Varme artikler
Varme artikler
-
 Udrydde et mærkeligt fænomen, der både hjælper og skader lithium-ion-batteriets ydeevneAli Sundermier En mystisk proces kaldet oxygenoxidation fjerner elektroner fra oxygenatomer i lithiumrige batterikatoder og forringer deres ydeevne, vist til venstre. Bedre forståelse af denne egenska
Udrydde et mærkeligt fænomen, der både hjælper og skader lithium-ion-batteriets ydeevneAli Sundermier En mystisk proces kaldet oxygenoxidation fjerner elektroner fra oxygenatomer i lithiumrige batterikatoder og forringer deres ydeevne, vist til venstre. Bedre forståelse af denne egenska -
 Forskning afslører, hvorfor det er svært at få lugten ud af polyesterKredit:Unsplash/CC0 Public Domain Hvorfor er den yndlingsskjorte den du har båret rundt i huset siden COVID-19 startede, stadig stinker, selv efter almindelig vask? Sandsynligvis indeholder det p
Forskning afslører, hvorfor det er svært at få lugten ud af polyesterKredit:Unsplash/CC0 Public Domain Hvorfor er den yndlingsskjorte den du har båret rundt i huset siden COVID-19 startede, stadig stinker, selv efter almindelig vask? Sandsynligvis indeholder det p -
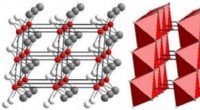 Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r
Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r -
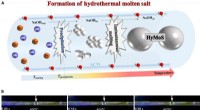 Et nyt opløsningsmiddelsystem:Hydrotermalt smeltet saltDannelse af HyMoS. (A) Skema for dannelsen af HyMoS i SCW, med eksemplet på NaOH. (B) Montagebillede fra film S1 (nedenfor), der viser den direkte observation og bevægelse af en smeltet NaOH -dråbe
Et nyt opløsningsmiddelsystem:Hydrotermalt smeltet saltDannelse af HyMoS. (A) Skema for dannelsen af HyMoS i SCW, med eksemplet på NaOH. (B) Montagebillede fra film S1 (nedenfor), der viser den direkte observation og bevægelse af en smeltet NaOH -dråbe
- Undersøgelsen tager det lange blik på Santa Barbaras kystlinjes sårbarhed og giver muligheder for…
- Affaldssporingssatellitter hjælper Indonesien med at tackle havaffald
- Den ultimative lugttest:Enheden sender advarsel om rådden mad til smartphones
- Bølgethed forklarer, hvorfor kulstofnanorørskove har lav stivhed
- 10 innovative arkitekter at se på
- At finde blandingen:Solcelleeffektivitet en delikat balance


