Kortlægning af elektriske felter for at hjælpe med at opklare, hvordan enzymer virker
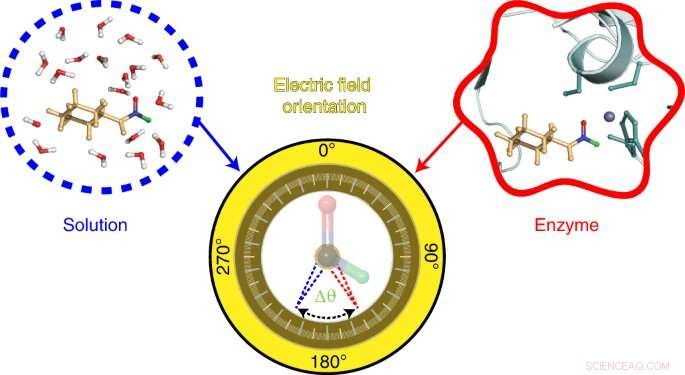
Grafisk abstrakt. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00937-w
Hvert øjeblik i vores krops celler forekommer utallige aktiviteter, der er livsvigtige, takket være enzymer. Disse specielle proteiner fungerer som katalysatorer ved at accelerere tempoet og forbedre selektiviteten af kemiske reaktioner uden selv at gennemgå permanente ændringer. Ud over deres uundværlige rolle i biologien er enzymer også kritiske for utallige processer i fødevare-, medicinal-, landbrugs- og kosmetikindustrien.
I betragtning af deres allestedsnærværende og betydning er enzymer dårligt forstået. Forskere ønsker især at vide, hvad der gør enzymers aktive steder - den lommelignende region, hvor de fremskyndede kemiske reaktioner finder sted - så kraftige. Mens de tredimensionelle atomstrukturer af mange enzymers aktive steder er blevet visualiseret og kortlagt, er den "usynlige" struktur af de elektriske felter inde i et aktivt sted for det meste ukendt. Disse elektriske felter er teoretiseret til at spille en vigtig rolle i dannelsen af et præcist miljø på aktive steder, hvor molekyler reagerer og hurtigt overgår til nye molekyler.
Nu har en undersøgelse ledet af Stanford-forskerne Chu Zheng og Yuezhi Mao debuteret en ny sonde til måling og visualisering af de elektriske felter inde i et enzyms aktive sted. Artiklen, der for nylig er offentliggjort i tidsskriftet Nature Chemistry , rapporterer om orienteringen af elektriske felter på reaktionsstedet og kunne hjælpe forskere med at beregne de vigtigste kemiske interaktioner i aktive steder. Disse indsigter kan til gengæld føre til at bygge skræddersyede syntetiske enzymer til industrien, samt i høj grad fremme opdagelsen og designet af nye lægemidler, der interfererer med eller modulerer funktionen af enzymmål.
"Vi har udviklet en ny sonde, der kan give os vigtig information om, hvordan elektriske felter er unikt orienteret i enzymer, hvilket vi mener er fundamentalt for enzymernes fantastiske katalytiske kraft," sagde Zheng, en kandidatstuderende i laboratoriet hos Steven G. Boxer, Camille Dreyfus-professor i kemi.
"På et grundlæggende niveau forsøger vi bedre at forstå, hvordan enzymer virker, og i denne undersøgelse tilføjer vi en ny dimension ved at bringe elektriske feltorienteringer ind, som menes at have en kritisk indvirkning på enzymets katalytiske funktioner," sagde Mao. en postdoc i kemi, der arbejder i laboratoriet hos Thomas Markland, en lektor i kemi ved Stanford og også en senior medforfatter.
Et potent nyt værktøj
Boxer-laboratoriet i Stanford har været banebrydende for konceptet med at fortolke funktionaliteten af enzymer ved at måle elektrostatiske interaktioner, som er til stede i alle former for stof og er specifikt organiseret i tre dimensioner i store biologiske molekyler.
"Oprindelsen af enzymernes fantastiske funktionalitet er et generelt spørgsmål, og det gælder ikke kun for biologisk katalyse, men også kemisk katalyse - hvilket er en enorm forretning," sagde Boxer. "Omtrent 80 procent af alle kemikalier er fremstillet ved hjælp af katalysatorer, men hvad der faktisk er ansvarligt for at sænke aktiveringsfri energi [for at få reaktionen til at forløbe hurtigere] er ikke godt forstået for de fleste reaktioner. At undersøge elektriske felters rolle i enzymfunktionen er meget meget i hjertet af vores arbejde," sagde Boxer, formanden for Department of Chemistry ved Stanford's School of Humanities and Sciences og en senior medforfatter af undersøgelsen.
Sonden udviklet af Stanford-teamet er afhængig af en teknik - også udviklet i Boxer-laboratoriet - kaldet vibrationel Stark-effektspektroskopi. Denne teknik måler vibrationsfrekvenserne i probemolekyler baseret på bølgelængden af infrarødt lys absorberet af dets kemiske bindinger. Forskydninger i disse vibrationsfrekvenser afslører information om de tilstedeværende elektriske felter. I denne undersøgelse undersøgte forskerne skift i vibrationsfrekvenserne af kemiske bindinger i en sonde lavet af et molekyle kaldet N-cyclohexylformamid. Dette molekyle virker som en inhibitor, der binder til det aktive sted af et enzym kaldet leveralkoholdehydrogenase.
To visualize the electric field in the active site of liver alcohol dehydrogenase, the researchers targeted two bonds in the N-cyclohexylformamide probe about 120 degrees away from each other. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment
The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work." + Udforsk yderligere
An enzyme's evolution from changing electric fields and resisting antibiotics
 Varme artikler
Varme artikler
-
 "How to Calculate Heat Flux, 3, [[ Varmeflux eller varmeoverførsel pr. hastighedsenhedsareal er en nyttig mængde i applikationer såsom bestemmelse af overførsel af energi fra en brændstofplade til arbejdsvæske, såsom i en
"How to Calculate Heat Flux, 3, [[ Varmeflux eller varmeoverførsel pr. hastighedsenhedsareal er en nyttig mængde i applikationer såsom bestemmelse af overførsel af energi fra en brændstofplade til arbejdsvæske, såsom i en -
 En visuel database over humane plasmaforbindelserDatabasen er i stand til at kortlægge sammenhængen mellem de forskellige metabolitter, at tilbyde besøgende yderligere forskningsmuligheder. Kredit:Tohoku Medical Megabank Organization Forskere i
En visuel database over humane plasmaforbindelserDatabasen er i stand til at kortlægge sammenhængen mellem de forskellige metabolitter, at tilbyde besøgende yderligere forskningsmuligheder. Kredit:Tohoku Medical Megabank Organization Forskere i -
 Hvordan elektriske felter påvirker et molekylært twist i lysfølsomme proteinerNår lys rammer visse kromoforer i proteiner, det får dem til at vride sig og ændre form. Denne atomare rekonfiguration, kendt som fotoisomerisering, ændrer molekylets kemiske og fysiske egenskaber. Ke
Hvordan elektriske felter påvirker et molekylært twist i lysfølsomme proteinerNår lys rammer visse kromoforer i proteiner, det får dem til at vride sig og ændre form. Denne atomare rekonfiguration, kendt som fotoisomerisering, ændrer molekylets kemiske og fysiske egenskaber. Ke -
 Klem stødet ud:Hvad forskellige faser af piezoelektriske materialer fortæller osForskere fra Gwangju Institut for Videnskab og Teknologi i Korea har undersøgt transformationsdynamikken induceret af et elektrisk felt i epitaksiale tyndfilm med blandet fase lanthanum-doteret bismut
Klem stødet ud:Hvad forskellige faser af piezoelektriske materialer fortæller osForskere fra Gwangju Institut for Videnskab og Teknologi i Korea har undersøgt transformationsdynamikken induceret af et elektrisk felt i epitaksiale tyndfilm med blandet fase lanthanum-doteret bismut
- Video:Geologer udforsker grotteisens historie
- Isle Royale-ulvebestanden stiger efter næsten at være død
- GateHouse, Gannett fusionerer for $ 1.4B, bygge avisgigant
- No-till-praksis i sårbare områder reducerer jorderosion markant
- Billede:Klargøring af Parker Solar Probe til rummet
- Peak break:Kina tilføjer øko -toilet på Mount Everest


