Peptid-fingeraftryk muliggør tidligere diagnosticering af Alzheimers sygdom

Neurale netværk kan detektere små forskelle i farvemønstrene fra tørrede peptidopløsninger (venstre:amyloid beta (Aβ42) peptid; højre:mutation). Kredit:Karlsruhe Institute of Technology
Neurodegenerative sygdomme som Alzheimers sygdom eller Parkinsons sygdom er forårsaget af foldningsfejl (fejlfoldning) i proteiner eller peptider, det vil sige ændringer i deres rumlige struktur. Dette er resultatet af små afvigelser i den kemiske sammensætning af biomolekylerne. Forskere ved Karlsruhe Institute of Technology (KIT) har udviklet en enkel og effektiv metode til at opdage en sådan fejlfoldning på et tidligt stadium af sygdommen. Fejlfoldning afsløres af strukturen af tørret rest fra protein- og peptidopløsninger. Metoden går ud på at analysere mikrofotografier med neurale netværk og har en prædiktiv nøjagtighed på mere end 99 %. Resultaterne er blevet offentliggjort i Advanced Materials .
Den biokemiske struktur af proteiner og peptider bestemmer deres biologiske funktioner. Meget tyder på, at selv små strukturelle eller rumlige ændringer kan fremme udviklingen af sygdomme. Mange neurodegenerative sygdomme er blevet tilskrevet fejlfoldning af proteiner og peptider, der er forårsaget af sådanne ændringer. Amyloid beta (Aβ42) peptider spiller en nøglerolle i Alzheimers sygdom; de adskiller sig i en enkelt aminosyrerest og repræsenterer arvelige mutanter af Alzheimers sygdom.
Indtil nu har der ikke været en enkel og præcis metode til at forudsige mutationer i proteiner. På KIT's Institute of Functional Interfaces (IFG) har en forskergruppe ledet af professor Jörg Lahann udviklet en metode til at påvise fejlfoldning via strukturen af tørrede protein- og peptidopløsninger. "Pletmønstrene var ikke kun karakteristiske og reproducerbare, men resulterede også i en klassificering af otte mutationer med en forudsigelig nøjagtighed på mere end 99%," sagde Lahann, forfatter til undersøgelsen, i beskrivelsen af resultaterne. Gruppen viste, at afgørende information om de primære og sekundære strukturer af peptider kan udvindes fra de efterladte pletter ved at tørre dråber af peptidopløsning på en fast overflade.
Farvemønstre som nøjagtige peptidfingeraftryk
Protein- og peptidopløsningerne placeres præcist på objektglas af et automatiseret pipetteringssystem for at sikre kontrollerede og reproducerbare resultater. Overfladerne af objektglassene blev forberedt på forhånd med en hydrofob polymerbelægning. For at analysere de komplekse farvemønstre fra de tørrede dråber erhvervede forskerne billeder ved hjælp af polarisationsmikroskopi. Billederne blev derefter analyseret med deep-learning neurale netværk.
"Da strukturerne er meget ens og svære at skelne med det blotte øje, var det bestemt en overraskelse, at de neurale netværk var så effektive," siger Lahann om resultaterne. "Pletningsmønstrene for amyloid beta-peptider tjener som nøjagtige fingeraftryk, der afspejler den strukturelle og rumlige identitet af et peptid." Denne teknologi muliggør identifikation af Alzheimer-varianter med maksimal opløsning inden for få minutter, ifølge Lahann.
Simpel prøveforberedelse giver hurtige diagnoser
Resultaterne tyder på, at en metode så simpel som at tørre en dråbe peptidopløsning på en fast overflade kan tjene som en indikator for små forskelle i de primære og sekundære strukturer af peptider. "Skalerbare og nøjagtige detektionsmetoder til stratificering af konformationelle og strukturelle proteinændringer er et presserende behov for at afkode de patologiske signaturer af sygdomme som Alzheimers og Parkinsons," siger Lahann.
Det er også en forholdsvis simpel metode, der ikke kræver nogen omfattende forberedelse af prøver og dermed muliggør en enkel og patientvenlig diagnose. Endvidere har metoden et stort potentiale for andre anvendelser inden for medicinsk diagnostik og til molekylær detektion af sygdomme. + Udforsk yderligere
Massespektrometri til påvisning af nøglemarkører for Alzheimers
Sidste artikelOrme som model for personlig medicin
Næste artikelBillig syntese af carbidmaterialer med højt smeltepunkt
 Varme artikler
Varme artikler
-
 Hvad er der indeholdt i en permanent markør?Selvom du muligvis bruger permanente markører hver dag, er du sandsynligvis hårdt presset for at forklare, hvordan de fungerer. Alle markører indeholder basale ingredienser, der udgør markører. Dis
Hvad er der indeholdt i en permanent markør?Selvom du muligvis bruger permanente markører hver dag, er du sandsynligvis hårdt presset for at forklare, hvordan de fungerer. Alle markører indeholder basale ingredienser, der udgør markører. Dis -
 Video:De eksplosive konsekvenser af ko bøvserKredit:The American Chemical Society Køer bøvser mere gas, end du måske tror muligt, når de fordøjer græs. Det meste af den gas er metan, en potent drivhusgas, hvilket er dårlige nyheder for plan
Video:De eksplosive konsekvenser af ko bøvserKredit:The American Chemical Society Køer bøvser mere gas, end du måske tror muligt, når de fordøjer græs. Det meste af den gas er metan, en potent drivhusgas, hvilket er dårlige nyheder for plan -
 Sådan beregnes molfraktioner ved hjælp af masseprocent <p> <p> Du kan bestemme koncentrationen af …Du kan udtrykke en vægtprocent opløsning som x vægtprocent opløst stof. Dette er den foretrukne metode til at udtrykke koncentration af kommercielle syreopløsninger. F.eks. Er kommerciel koncentreret
Sådan beregnes molfraktioner ved hjælp af masseprocent <p> <p> Du kan bestemme koncentrationen af …Du kan udtrykke en vægtprocent opløsning som x vægtprocent opløst stof. Dette er den foretrukne metode til at udtrykke koncentration af kommercielle syreopløsninger. F.eks. Er kommerciel koncentreret -
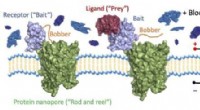 Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran
Forskere udvikler molekylær fiskeri for at finde individuelle molekyler i blodDenne figur illustrerer en protein-nanopore-baseret sensor til påvisning af proteiner i en kompleks biologisk væske ved enkeltmolekylær præcision. På venstre side, sensoren, som er et konstrueret tran


