Nyt materiale baner vejen for fjernstyret medicin og elektroniske piller
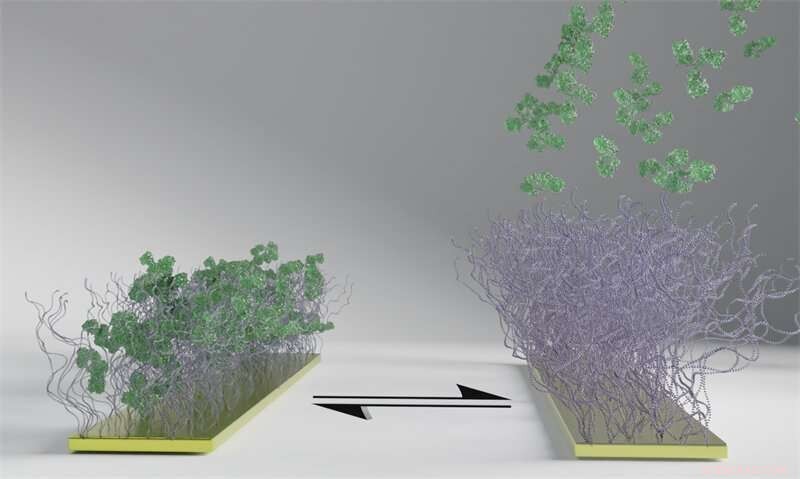
Polymeroverfladen, der ses som børster på billedet, reagerer på en elektrisk puls ved at skifte tilstand fra at fange til at frigive de grønne biomolekyler. Polymeroverfladen fanger først biomolekylerne (venstre), og når elektriciteten er tændt, frigiver de dem (højre). I modsætning til biomolekylerne forbliver polymerbørsterne fastgjort trods den elektriske puls, og processen kan gentages. Kredit:Chalmers Tekniske Universitet
Biomedicin produceres af levende celler og bruges blandt andet til at behandle kræft og autoimmune sygdomme. En udfordring er, at lægemidlerne er meget dyre at fremstille, hvilket begrænser den globale adgang. Nu har forskere fra Chalmers opfundet et materiale, der bruger elektriske signaler til at fange og frigive biomolekyler. Den nye og effektive metode kan få stor betydning for udviklingen af biomedicin og bane vejen for udviklingen af elektroniske piller og lægemiddelimplantater.
Det nye materiale er en polymeroverflade, som ved en elektrisk puls skifter tilstand fra at opfange til at frigive biomolekyler. Dette har flere mulige anvendelsesmuligheder, herunder brug som et værktøj til effektiv adskillelse af et lægemiddel fra de andre biomolekyler, som celler skaber i produktionen af biologiske lægemidler. Resultaterne af undersøgelsen blev for nylig offentliggjort i det videnskabelige tidsskrift Angewandte Chemie .
Biomedicin er meget dyr at producere på grund af manglen på en effektiv separationsteknik, og nye teknikker med et højere lægemiddeludbytte er nødvendige for at reducere produktionsomkostningerne og i sidste ende omkostningerne ved behandling af patienter.
"Vores polymeroverflader tilbyder en ny måde at adskille proteiner ved at bruge elektriske signaler til at kontrollere, hvordan de bindes til og frigives fra en overflade, uden at det påvirker strukturen af proteinet," siger Gustav Ferrand-Drake del Castillo, som offentligt forsvarede sin doktorafhandling i kemi på Chalmers og er hovedforfatter på undersøgelsen.
Den konventionelle separationsteknik - kromatografi - binder biomolekyler tæt til overfladen, og der kræves stærke kemikalier for at få dem til at frigives, hvilket fører til tab og et dårligt udbytte. Mange nye lægemidler har vist sig at være meget følsomme over for stærke kemikalier, hvilket skaber et stort produktionsproblem for næste generation af biomedicin. Det lavere forbrug af kemikalier giver en fordel for miljøet, mens det er en central egenskab, at overfladerne på det nye materiale også kan genbruges gennem flere cyklusser. Processen kan gentages hundredvis af gange uden at påvirke overfladen.
Funktioner i biologiske væsker
Materialet fungerer også i biologiske væsker med bufferkapacitet, med andre ord væsker med evne til at modvirke ændringer i pH-værdien. Denne egenskab er bemærkelsesværdig, da den baner vejen for skabelsen af en ny teknik til implantater og elektroniske "piller", der frigiver medicinen til kroppen via elektronisk aktivering.
"Du kan forestille dig en læge eller et computerprogram, der måler behovet for en ny dosis medicin hos en patient, og et fjernstyret signal aktiverer frigivelsen af lægemidlet fra implantatet, der er placeret i netop det væv eller organ, hvor det er nødvendigt. ," siger Gustav Ferrand-Drake del Castillo.
Lokal, aktiveret lægemiddelfrigivelse er tilgængelig i dag i form af materialer, der ændrer deres tilstand i tilfælde af en ændring i det omgivende kemiske miljø. Eksempelvis fremstilles tabletter af pH-følsomt materiale, hvor man ønsker at kontrollere frigivelsen af et lægemiddel i mave-tarmkanalen, som er et miljø med naturlige variationer i pH-værdi. Men i de fleste af kroppens væv er der ingen ændringer i pH-værdi eller andre kemiske parametre.
"At være i stand til at kontrollere frigivelsen og optagelsen af proteiner i kroppen med minimale kirurgiske indgreb og uden nåleindsprøjtninger er, mener vi, en unik og nyttig egenskab. Udviklingen af elektroniske implantater er kun en af flere tænkelige anvendelser, der er mange år inde i fremtiden. Forskning, der hjælper os med at forbinde elektronik med biologi på molekylært niveau, er en vigtig brik i puslespillet i en sådan retning," siger Gustav Ferrand-Drake del Castillo.
En anden fordel ved den nye metode er, at den ikke kræver store mængder energi. Det lave strømforbrug skyldes, at dybden af polymeren på overfladen af elektroden er meget tynd, på nanometerskalaen, hvilket betyder, at overfladen reagerer med det samme på små elektrokemiske signaler.
"Elektronik i biologiske miljøer er ofte begrænset af størrelsen af batteriet og de bevægelige mekaniske dele. Aktivering på molekylært niveau reducerer både energibehovet og behovet for bevægelige dele," siger Gustav Ferrand-Drake del Castillo.
Gennembruddet begyndte som en doktorafhandling
Forskningen bag teknikken blev udført i den periode, hvor Ferrand-Drake del Castillo var doktorand i Chalmers-professor Andreas Dahlins forskerhold i afdelingen for anvendt overfladekemi. Projektet involverede polymeroverflader, der skifter tilstand mellem at være neutrale og ladede afhængigt af pH-værdien af den omgivende opløsning. Det lykkedes for forskerne derefter at skabe et materiale, der var stærkt nok til at blive på overfladen, når det udsættes for gentagne elektriske signaler, samtidig med at det var tyndt nok til faktisk at ændre pH-værdien som følge af elektrokemien på overfladen.
"Kort efter opdagede vi, at vi kunne bruge de elektriske signaler til at kontrollere bindingen og frigivelsen af proteiner og biomolekyler, og at elektrodematerialet virker i biologiske opløsninger som serum og centrifugeret blod. Vi tror og håber, at vores opdagelser kan være af stor betydning. gavn i udviklingen af ny medicin,« siger Andreas Dahlin. + Udforsk yderligere
Forskere rapporterer om en bedre måde at skabe organisk bioelektronik på
 Varme artikler
Varme artikler
-
 Sådan praktiseres beregninger for mikrodrop per minutTilvejebringelse af intravenøs (IV) væske er et væsentligt element i sygepleje, da et væld af medicin og andre stoffer gives på denne rute, især i ambulante hospitaler. IV-administration har fordelen
Sådan praktiseres beregninger for mikrodrop per minutTilvejebringelse af intravenøs (IV) væske er et væsentligt element i sygepleje, da et væld af medicin og andre stoffer gives på denne rute, især i ambulante hospitaler. IV-administration har fordelen -
 Team skaber mikrober for at omdanne affald til nyttige kemikalierForskere gensplejsede bakterier til produktion af itaconsyre, skabe dynamiske kontroller, der adskiller mikrobielle vækst- og produktionsfaser for øget effektivitet og syreudbytte. Kredit:NREL Et
Team skaber mikrober for at omdanne affald til nyttige kemikalierForskere gensplejsede bakterier til produktion af itaconsyre, skabe dynamiske kontroller, der adskiller mikrobielle vækst- og produktionsfaser for øget effektivitet og syreudbytte. Kredit:NREL Et -
 Naturligt molekyle til at øge ydeevnen af elektroder til genopladelige batterierPorphyrinmolekylet – brugt i elektroder – fremskynder opladningsprocessen af batterier i laboratoriet. Kredit:KIT/HIU Klorofyl, blod, og vitamin B12 er alle baseret på porfyrinmolekylet. Men por
Naturligt molekyle til at øge ydeevnen af elektroder til genopladelige batterierPorphyrinmolekylet – brugt i elektroder – fremskynder opladningsprocessen af batterier i laboratoriet. Kredit:KIT/HIU Klorofyl, blod, og vitamin B12 er alle baseret på porfyrinmolekylet. Men por -
 Nanomaterialestof ødelægger nervemidler i forhold til slagmarkenKompositter fremstillet af metal-organiske rammer kan ødelægge nervemidler under relevante forhold. Kredit:Journal of the American Chemical Society Northwestern University forskere har med succes
Nanomaterialestof ødelægger nervemidler i forhold til slagmarkenKompositter fremstillet af metal-organiske rammer kan ødelægge nervemidler under relevante forhold. Kredit:Journal of the American Chemical Society Northwestern University forskere har med succes
- Dette hold af amatører byggede en satellit, som NASA tager til rummet
- Sådan beregnes en gennemsnitlig procentændring
- Indiske astronomer undersøger røntgenpulsar 2S 1417–624
- Nyt datasæt afslører tendenser i samfundsvidenskabsfolks kongresvidnesbyrd
- Germania flyselskab oplyser, at det er begæret konkurs, aflyser alle flyvninger
- Internetkabel afslører kilden til undervandsvibrationer


