Ny indsigt i fermenteringsenzymer vil sænke den kemiske industris CO2-fodaftryk
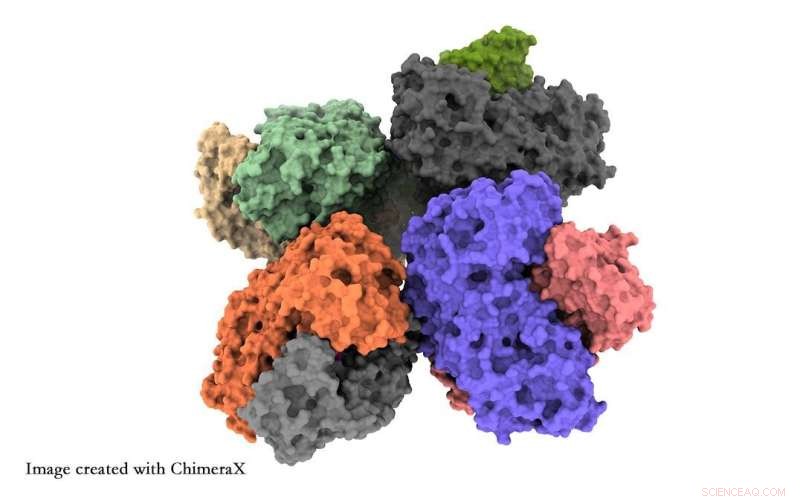
Forskere fra University of Tsukuba har opnået indsigt på atomniveau i strukturen af phosphoketolase-enzymet, hvilket vil hjælpe forskere med at optimere dette enzym til kemisk råstofsyntese. Kredit:University of Tsukuba
Farmaceutiske, plastiske og andre industrier bruger enzymer til at hjælpe med at syntetisere molekylære råvarer. Enzymer taget direkte fra mikrober såsom bakterier er ofte ikke optimale til industriel brug; et problem er, at de ofte ikke overlever de forhøjede temperaturer, der fremskynder en syntese. Genteknologi kan hjælpe med at skræddersy enzymer til disse formål. Kendskab til den nøjagtige atom-for-atom struktur af det oprindelige enzym er vigtig for at forstå enzymfunktion i naturen, og giver dermed indsigt i, hvordan man optimerer genteknologien af enzymer. Imidlertid kan røntgenkrystallografi, en almindelig teknik til at bestemme et enzyms struktur som et kritisk trin i denne proces, desværre også ændre dets struktur.
En teknik kendt som kryogen elektronmikroskopi (cryo-EM) kan give et lignende niveau af strukturelle detaljer som røntgenkrystallografi, mens det native enzyms struktur bevares. Faktisk blev Nobelprisen i kemi 2017 tildelt for at bruge denne teknik til at bestemme strukturen af biologiske molekyler. Nu i en undersøgelse for nylig offentliggjort i Journal of Structural Biology , har forskere fra University of Tsukuba og samarbejdspartnere brugt cryo-EM til at bestemme strukturen af fermenteringsenzymet phosphoketolase. Dette arbejde vil lette genteknologien af enzymet til industrielle synteser.
"Røntgenkrystallografi har revolutioneret, hvordan forskere identificerer proteinstrukturer, men udviklingen af alternative midler, der bedre afspejler de strukturer, der ses i biologien, er uvurderlige," forklarer seniorforfatter professor Kenji Iwasaki. "Vores brug af cryo-EM som billedværktøj har afsløret tidligere skjulte strukturelle detaljer i phosphoketolase, som direkte vil gavne den kemiske industri."
Forskerne rapporterer om to hovedfund. Først klynger otte fosfoketolase-enheder sammen i en struktur, kendt som en oktamer. For det andet observerede de detaljer om en kæde af aminosyrer kendt som QN-løkken, der kan diktere, om det funktionelle sted for enzymet er åbent eller lukket. Dette er et muligt middel til at øge den kemiske produktion af enzymet.
Røntgenkrystallografi skjuler de strukturelle detaljer, som kryo-EM giver. Oktameren blev tidligere observeret ved røntgenkrystallografi, men blev anset for blot at være en måleartefakt. Derudover savner røntgenkrystallografi de åbne/lukkede strukturelle detaljer.
"Industrien vil nu være i stand til at korrelere phosphoketolases funktion med dens korrekte struktur," siger Iwasaki. "Vi forventer, at disse indsigter vil minde forskerne om, at røntgenkrystallografi ikke nødvendigvis er det sidste ord om enzymstruktur; cryo-EM kan tilbyde værdifuld indsigt."
Resultaterne af denne undersøgelse er vigtige for at optimere ydeevnen af et fermenteringsenzym, der er nyttigt til at udføre kemiske synteser i industrien. Ved at bruge enzymstrukturel indsigt til at maksimere succesen med genteknologi, kan råvarer fremstilles til lægemidler, plastik og andre materialer på en miljømæssigt bæredygtig måde. + Udforsk yderligere
Metan-spisende bakterier omdanner drivhusgasser til brændstof
 Varme artikler
Varme artikler
-
 Kliniske test viser, at biosensorer kan bane vejen for en personlig antibioterapi i fremtidenIllustration af point-of-care test (POCT) scenariet. Kredit:IMTEK – Laboratorium for sensorer Personlig lægemiddelbehandling, der justerer dosis, doseringsintervaller, og varigheden af behandlin
Kliniske test viser, at biosensorer kan bane vejen for en personlig antibioterapi i fremtidenIllustration af point-of-care test (POCT) scenariet. Kredit:IMTEK – Laboratorium for sensorer Personlig lægemiddelbehandling, der justerer dosis, doseringsintervaller, og varigheden af behandlin -
 Genanvendelige vandbehandlingspartikler eliminerer effektivt BPARice University-forskere har forbedret titaniumdioxidpartikler i mikronstørrelse for at fange og ødelægge BPA, et vandforurenende stof med sundhedsmæssige konsekvenser. Cyclodextrin molekyler på overf
Genanvendelige vandbehandlingspartikler eliminerer effektivt BPARice University-forskere har forbedret titaniumdioxidpartikler i mikronstørrelse for at fange og ødelægge BPA, et vandforurenende stof med sundhedsmæssige konsekvenser. Cyclodextrin molekyler på overf -
 Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm
Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm -
 Billig detektor er som velcro til kræftcellerKredit:American Chemical Society Forskere har udviklet en ny type sensor, der fungerer som velcro for prostatacancerceller, klæbe dem på et modificeret matglas, som dem, der bruges i naturfag, så
Billig detektor er som velcro til kræftcellerKredit:American Chemical Society Forskere har udviklet en ny type sensor, der fungerer som velcro for prostatacancerceller, klæbe dem på et modificeret matglas, som dem, der bruges i naturfag, så
- Planter og dyr Unikt til Atchafalaya-flodbassinet
- Er der struktur i glasforstyrrelse?
- Står over for raseri over falske websteder, Grubhub siger, at restauranter tager fejl
- Forskere afslører de skjulte omkostninger ved koboltminedrift i DR Congo
- Silicium nanokrystaller kortlægger placeringen af spredning af tumorer
- NASAs luftundersøgelse af polar is udvider sin arktiske rækkevidde


