Forskere udvikler en ny tilgang til at forhøre vævsspecifikke protein-protein-interaktioner
Flercellede organismer, som dyr og planter, har komplekse celler med forskellige funktioner. Denne kompleksitet opstår som følge af behovet for celler til at producere forskellige proteiner, der interagerer med hinanden. Denne interaktion er afgørende for, at celler kan udføre deres specifikke opgaver og danne komplekst molekylært maskineri.
Imidlertid mangler vores nuværende forståelse af sådanne protein-protein-interaktioner ofte cellulære sammenhænge, fordi de normalt blev undersøgt i et in vitro-system eller i celler isoleret fra deres vævsmiljø. Effektive metoder til at undersøge protein-protein-interaktioner på en vævsspecifik måde mangler stort set.
For at bygge bro over denne teknologiske kløft har et samarbejdende forskerhold fra The University of Hong Kong (HKU), ledet af professor Xiang David Li fra Institut for Kemi og professor Chaogu Zheng fra School of Biological Sciences, begge fra Det Naturvidenskabelige Fakultet, sammen med Dr. Xiucong Bao fra School of Biomedical Sciences, Li Ka Shing Fakultet for Medicin, for nylig udviklet en ny kemisk biologi tilgang.
Holdet mærkede proteiner fra specifikke celler med en bifunktionel aminosyreprobe, der gør det muligt at isolere de mærkede proteiner og fanger protein-protein-interaktioner gennem foto-tværbinding.
Denne nye metode, Methionine Analog-based Cell-Specific Proteomics and Interactomics (MACSPI), har gjort det muligt for teamet at identificere mange nye vævsspecifikke proteiner og proteininteraktioner, hvilket hjælper os med bedre at forstå, hvordan celler fungerer i levende organismer og studere forskellige biologiske problemer, såsom organudvikling og sygdomspatogenese.
Værket blev for nylig offentliggjort i Proceedings of the National Academy of Sciences .
Innovativt design
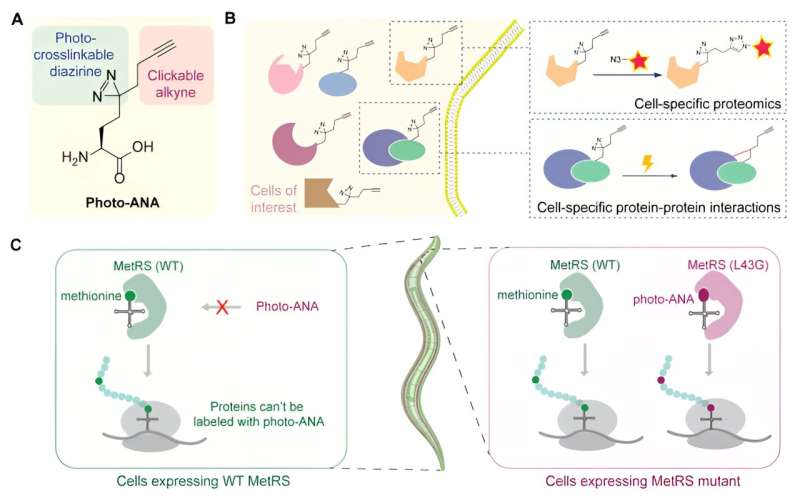
Holdet designede og syntetiserede en unaturlig aminosyre (foto-ANA), der strukturelt ligner methionin, den naturligt forekommende aminosyre, men med to yderligere komponenter.
En komponent er en alkyngruppe, som kan bruges som et kemisk håndtag for de mærkede proteiner, der skal ekstraheres og renses. Den anden er en diaziringruppe, som kan aktiveres af lys for at skabe stabile kovalente bindinger mellem de mærkede proteiner og eventuelle molekyler, de interagerer med.
Derefter konstruerede holdet et enzym kaldet MetRS for at skabe en variant, der kan genkende og inkorporere den unaturlige aminosyre i proteiner, mens de bygges. Ved at kontrollere ekspressionen af dette konstruerede enzym i specifikke væv mærkes kun proteiner fra vævet af interesse med kemisk probe. Med lys-induceret tværbinding kan proteinkomplekser fra specifikke væv desuden fanges og isoleres.
Som et proof-of-concept anvendte holdet MACSPI-metoden til at profilere proteiner fra henholdsvis muskelceller og neuroner i en modelorganisme kaldet C. elegans og fandt mange nye vævsspecifikke proteiner.
Holdet demonstrerede også metodens anvendelighed til at fange vævsspecifik protein-protein-interaktion ved at identificere vævsspecifikke interaktører af et allestedsnærværende udtrykt protein, såsom den molekylære chaperone kaldet HSP90. Det blev fundet, at HSP90 binder sig til forskellige sæt proteiner for at regulere forskellige biologiske processer i muskler og neuroner.
"Denne undersøgelse er et glimrende eksempel på, hvordan innovative kemiske mærkningsmetoder kan hjælpe med at løse vanskelige biologiske problemer," sagde professor Xiang David Li.
"Forståelse af protein-protein-interaktion ved den cellulære opløsning er ofte afgørende for at dechifrere den molekylære mekanisme i en patologisk proces. For eksempel er vi i øjeblikket ved at udforske funktionerne af de neuronale HSP90-interaktorer, vi identificerede; nogle ser ud til at være involveret i neurodegeneration i en Parkinsons sygdom sygdomsmodel," sagde professor Chaogu Zheng.
Holdet forestiller sig, at MACSPI-metoden kan bruges i mange flercellede organismer til at profilere proteomer og interaktomer med rumlig og tidsmæssig specificitet, hvilket kan facilitere et bredt spektrum af biologisk og biomedicinsk forskning.
Flere oplysninger: Siyue Huang et al., MACSPI muliggør vævsselektive proteomiske og interaktomiske analyser i flercellede organismer, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2319060121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af The University of Hong Kong
 Varme artikler
Varme artikler
-
 Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik -
 Kaffe-ring effekt udnyttet til at give hurtig, lavprisanalyse af postevandPostevandsdråber fra to bygninger på Michigan State University campus efterlader forskellige kafferingmønstre; hårdt vand vises til venstre, og vand behandlet med et blødgøringsmiddel er vist til højr
Kaffe-ring effekt udnyttet til at give hurtig, lavprisanalyse af postevandPostevandsdråber fra to bygninger på Michigan State University campus efterlader forskellige kafferingmønstre; hårdt vand vises til venstre, og vand behandlet med et blødgøringsmiddel er vist til højr -
 Kampen mod svære at behandle svampeinfektionerKonidioforer med konidier af de mikroskopiske svampe Aspergillus oryzae under lysmikroskop. Kredit:Yulianna.x / Wikimedia / CC BY-SA 4.0 Systemiske svampeinfektioner er meget sjældnere end andre s
Kampen mod svære at behandle svampeinfektionerKonidioforer med konidier af de mikroskopiske svampe Aspergillus oryzae under lysmikroskop. Kredit:Yulianna.x / Wikimedia / CC BY-SA 4.0 Systemiske svampeinfektioner er meget sjældnere end andre s -
 Ny naturgaskatalysator ville øge ren transportMichael Harald, en kemiingeniør ved University of Houston, vil lede et projekt på $2 millioner for at udvikle og optimere en lavere pris, mere effektiv katalysator til at eliminere uomsat metan. Kredi
Ny naturgaskatalysator ville øge ren transportMichael Harald, en kemiingeniør ved University of Houston, vil lede et projekt på $2 millioner for at udvikle og optimere en lavere pris, mere effektiv katalysator til at eliminere uomsat metan. Kredi
- Trump til Apple:Lav dit produkt i USA
- Fysikere demonstrerer det første kvantecomputernetværk i storbyområdet i Boston
- Ny indsigt i at bevise matematisk millionproblem:Riemann-hypotesen (opdatering)
- Nanopartikler genstarter blodgennemstrømningen i hjernen
- På linjen:At se nanopartikler komme i form
- Kortlægning af Honduras vandforsyning


