En ny chance for et nyt antibiotisk middel
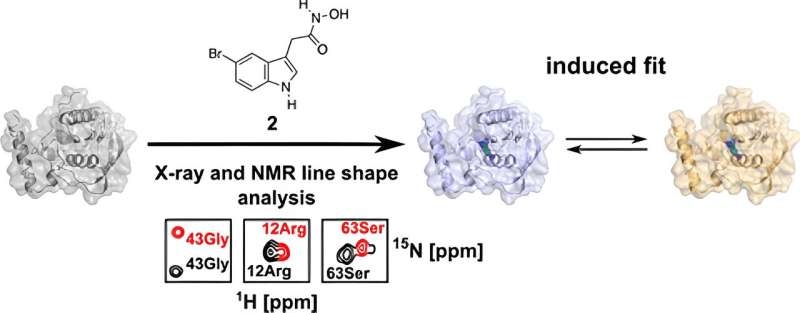
Et stigende antal bakterier er blevet resistente over for mange almindeligt anvendte antibiotika. Forskere fra Bochum har opdaget en ny mulighed for et potentielt aktivt molekyle, hvis forgænger blev afvist. Ved at studere dets interaktion med det bakterielle målprotein meget præcist i tre dimensioner, identificerede de et tidligere uopdaget angrebspunkt, som kunne være målrettet af denne forbindelse.
"Da dette angrebspunkt kun forekommer i bakterielle proteiner, ville lægemidlet blive meget mere selektivt, og dets skadelighed for menneskelige celler ville blive reduceret," forklarer professor Raphael Stoll, leder af forskningsgruppen Biomolecular NMR Spectroscopy ved Det Kemiske og Biokemiske Fakultet. ved Ruhr University Bochum, Tyskland.
Forskerne offentliggjorde deres resultater den 4. april 2024 i Journal of Medicinal Chemistry .
Væsentlige forsøg for 20 år siden
Undersøgelsen fokuserede på protein peptid deformylase (PDF). PDF er involveret i proteinmodningsprocesser i celler og er afgørende for bakteriernes overlevelse. Det findes dog i både bakterier og menneskeceller. "For omkring 20 år siden blev der gjort betydelige forsøg på at bekæmpe PDF med antibiotika," påpeger Stoll.
"Alligevel måtte den oprindelige lægemiddelkandidat, actinonin, kasseres af flere årsager. Et af problemerne, var den nyopdagede humane PDF, som potentielt var forbundet med bivirkninger. Alligevel blev der udført yderligere forskning for at generere modificerede aktive forbindelser ," tilføjer Hendrik Kirschner.
Som en del af sin doktorafhandling undersøgte han PDF i detaljer i den aktuelle undersøgelse og analyserede den ud fra strukturbiologiens perspektiv ved hjælp af biomolekylær kernemagnetisk resonans (NMR) spektroskopi og røntgenkrystallografi. Disse teknikker gjorde det muligt for ham at opnå en 3D-struktur, der blev løst i den mindste detalje.
"Dette er resultatet af mange års samarbejde med vores kollega professor Eckhard Hofmann," siger Stoll.
Aktivt molekyle er tilpasset og gjort mere selektivt
"Vi kan bruge disse teknikker til at visualisere overflader og bindingslommer af biomolekyler og vise, at bindingen af molekyle til dette protein ikke er statisk, men dynamisk," forklarer Kirschner.
Forskerne bemærkede, at der er to forskellige bindingsorienteringer i proteinet for et modificeret lægemiddelmolekyle:Ud over den orientering, der også er til stede i human PDF, er der en anden, der i princippet udelukkende bør forekomme i bakteriel PDF.
"Dette får os til at modificere lægemiddelmolekylet, så det favoriserer den anden bindingsorientering," siger Stoll.
Som et resultat kunne det antibiotiske molekyle gøres mere selektivt. "Det kunne give denne lægemiddelkandidat en ny chance," slutter Kirschner.
Flere oplysninger: Hendrik Kirschner et al., Toward More Selective Antibiotic Inhibitors:A Structural View of the Complexed Binding Pocket of E. coli Peptide Deformylase, Journal of Medicinal Chemistry (2024). DOI:10.1021/acs.jmedchem.3c02382
Journaloplysninger: Journal of Medicinal Chemistry
Leveret af Ruhr-Universitaet-Bochum
 Varme artikler
Varme artikler
-
 At omdanne et farligt toksin til en biosensorKredit:Chan Cao, EPFL Nogle typer bakterier har evnen til at slå huller ind i andre celler og dræbe dem. Det gør de ved at frigive specialiserede proteiner kaldet poredannende toksiner (PFTer), de
At omdanne et farligt toksin til en biosensorKredit:Chan Cao, EPFL Nogle typer bakterier har evnen til at slå huller ind i andre celler og dræbe dem. Det gør de ved at frigive specialiserede proteiner kaldet poredannende toksiner (PFTer), de -
 Kollagenstrukturer får den kongelige afsløringEn algoritme af forskere fra Rice University forudsiger strukturer og smeltetemperaturer af kollagen, den tredobbelte spiral, der tegner sig for omkring en tredjedel af kroppens proteiner og danner fi
Kollagenstrukturer får den kongelige afsløringEn algoritme af forskere fra Rice University forudsiger strukturer og smeltetemperaturer af kollagen, den tredobbelte spiral, der tegner sig for omkring en tredjedel af kroppens proteiner og danner fi -
 Svovlfjernende bakterier kan være nøglen til at lave fælles komponent i plastikForskere har opdaget, hvordan mikrober i vandlidende jorde producerer høje niveauer af ethylen, hvilket kan have en negativ indvirkning på landbrugsafgrøder og bioenergiråvarer som skiftegræs. Denne n
Svovlfjernende bakterier kan være nøglen til at lave fælles komponent i plastikForskere har opdaget, hvordan mikrober i vandlidende jorde producerer høje niveauer af ethylen, hvilket kan have en negativ indvirkning på landbrugsafgrøder og bioenergiråvarer som skiftegræs. Denne n -
 ABS af molekylære motorerHarald Platta, Rebecca Brinkmeier og Thomas Mastalski (fra venstre) i laboratoriet på Ruhr-Universität Bochum. Kredit:RUB, Kramer Peroxisomer er celleorganeller, der udfører en række funktioner, h
ABS af molekylære motorerHarald Platta, Rebecca Brinkmeier og Thomas Mastalski (fra venstre) i laboratoriet på Ruhr-Universität Bochum. Kredit:RUB, Kramer Peroxisomer er celleorganeller, der udfører en række funktioner, h
- Alt-i-én-strategi for metalla[3]catenaner, Borromæiske ringe og ring-i-ring kompleks
- Bangladesh lukker et af verdens mest forurenede steder
- Den aleutiske vulkan udspringer askesky i to stærke udbrud
- Sådan frigiver NASA næsten en halv million gallons vand på 60 sekunder
- Hvordan lærer patogener at være patogener:Partnerskaber mellem mikrober, der fører til sygdomme h…
- Professor i musik optrævler århundreder gammelt forfatterskabsmysterium


