Forskere identificerer lægemiddelforbindelser, der kan reducere prionproteinniveauer i inficerede celler
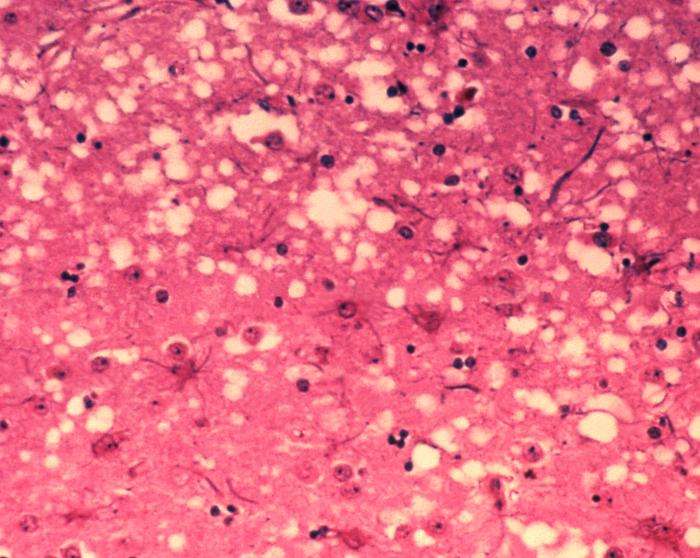
Prioner er de unormale, patogene stoffer, der er overførbare og er i stand til at inducere unormal foldning af specifikke normale cellulære proteiner.
Prionsygdom er en paraplybetegnelse for en gruppe dødelige og i øjeblikket ubehandlede neurodegenerative sygdomme, som ikke kun rammer mennesker, men også vilde og fangede dyr. Disse sygdomme omfatter Creutzfeldt-Jakobs sygdom (CJD) hos mennesker, bovin spongiform encephalopati (BSE eller "kogalskab") og kronisk svindsygdom (CWD), der påvirker hjorte, elge og elge.
Den centrale begivenhed i disse sygdomme er omdannelsen af prionproteinet (PrP C ) fra sin normale form til en patologisk struktur (PrP Sc ), der er giftig for neuroner og kan replikere sig selv gennem binding til ukonverteret PrP C molekyler. Denne evne til at replikere sig selv gør disse fejlfoldede proteiner smitsomme, hvilket har enorme konsekvenser for folkesundheden.
I en ny undersøgelse har forskere fra Boston University Chobanian &Avedisian School of Medicine identificeret 10 forbindelser, der er i stand til at reducere PrP Sc niveauer i inficerede celler og har vist, at de mest potente molekyler også kan forhindre den toksicitet, der blev observeret ved påføring af PrP Sc til dyrkede neuroner.
"Spændende nok har fem af disse molekyler en historie med anvendelse hos mennesker:rimcazol og haloperidol til neuropsykiatriske tilstande, (+)-pentazocin til neuropatisk smerte og SA 4503 og ANAVEX2-73, som er i kliniske forsøg for iskæmisk slagtilfælde og Alzheimers sygdom , henholdsvis," forklarede hovedforfatter Robert C.C. Mercer, Ph.D., underviser i biokemi og cellebiologi på skolen.
Forskerne havde oprindeligt undersøgt anti-prion-egenskaberne af disse molekyler, fordi de var kendt for at binde sig til sigma-receptorerne (σ1 R og σ2 R), som de havde grund til at tro var involveret i prionspredning. Ved hjælp af gen-knockout-teknologi (CRISPR) fastslog de, at sigma-receptorerne ikke var de relevante mål for disse lægemidler ud fra deres anti-prion-egenskaber.
Ved at bruge Neuro2a-celler (N2a) fra en eksperimentel model, der var blevet inficeret med prioner, blev disse celler derefter udsat for stigende koncentrationer af hvert lægemiddel og niveauerne af PrP Sc blev bestemt. De brugte derefter CRISPR-teknologi til at "redigere" σ1 R og σ2 R-gener, sådan at de ikke længere kodede for et protein, og fandt, at dette ikke havde nogen effekt på faldet i PrP Sc niveauer, de observerede, da de anvendte stofferne.
Dette fik dem til at konkludere, at σ1 R og σ2 R var ikke ansvarlige for anti-prion-virkningerne af disse lægemidler. De fortsatte derefter med at teste disse lægemidlers evne til at hæmme PrP C til PrP Sc konvertering og fandt, at de ikke havde nogen effekt på disse cellefri reaktioner, hvilket indikerer, at et andet protein medierer virkningerne af disse lægemidler.
Ifølge forskerne har prionsygdomme enorme folkesundhedsmæssige konsekvenser fra sikkerheden af blodforsyningen til korrekt dekontaminering af kirurgiske værktøjer, der bruges i neurokirurgi.
"Fra et klinisk synspunkt mener vi, at denne forskning har afsløret anti-prion egenskaber af lægemidler, der allerede har vist sig at være sikre at bruge hos mennesker. På grund af dette, især i betragtning af fraværet af nogen effektiv behandling for disse sygdomme, kunne disse forbindelser genbruges til behandling af prionsygdomme," sagde den korresponderende forfatter David A. Harris, MD, Ph.D., Edgar Minas Housepian-professor og formand for biokemi og cellebiologi på skolen.
Disse resultater vises online i tidsskriftet ACS Chemical Neuroscience .
Flere oplysninger: Robert C. C. Mercer et al., Sigma-receptorligander er potente antiprionforbindelser, der virker uafhængigt af Sigma-receptorbinding, ACS Chemical Neuroscience (2024). DOI:10.1021/acschemneuro.4c00095
Journaloplysninger: ACS Chemical Neuroscience
Leveret af Boston University School of Medicine
 Varme artikler
Varme artikler
-
 Madrester får et dristigt nyt livKredit:University of Tokyo De fleste mennesker tænker ikke meget over de madrester, de smider; imidlertid, forskere fra Institute of Industrial Science ved University of Tokyo har udviklet en ny m
Madrester får et dristigt nyt livKredit:University of Tokyo De fleste mennesker tænker ikke meget over de madrester, de smider; imidlertid, forskere fra Institute of Industrial Science ved University of Tokyo har udviklet en ny m -
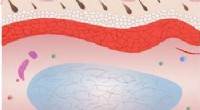 Hydrogel heler uden tilsætningsstofferEn illustration viser, hvordan over seks uger, fra top til bund, en hydrogel, der er udviklet ved Rice University, hjælper med vævsremodellering. Processen begynder med celleinfiltration efterfulgt af
Hydrogel heler uden tilsætningsstofferEn illustration viser, hvordan over seks uger, fra top til bund, en hydrogel, der er udviklet ved Rice University, hjælper med vævsremodellering. Processen begynder med celleinfiltration efterfulgt af -
 Omdannelse af CO2 til myresyre ved hjælp af en aluminiumoxid-understøttet, jernbaseret forbindelseEt udbredt jordmineral, alfa-jern-(III)-oxyhydroxid, viste sig at blive en genanvendelig katalysator for kuldioxid-fotoreduktion til myresyre. Kredit:Professor Kazuhiko Maeda Fotoreduktion af CO2 t
Omdannelse af CO2 til myresyre ved hjælp af en aluminiumoxid-understøttet, jernbaseret forbindelseEt udbredt jordmineral, alfa-jern-(III)-oxyhydroxid, viste sig at blive en genanvendelig katalysator for kuldioxid-fotoreduktion til myresyre. Kredit:Professor Kazuhiko Maeda Fotoreduktion af CO2 t -
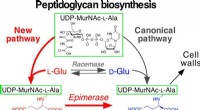 Ny biosyntetisk vej unik for patogene mikroorganismerDen nyligt opdagede vej involverer to gener, som letter bindingen af L-Glu til UDP-MurNAc-L-Ala og derefter epimeriserer (isomeriserer) L-Glu til D-Glu. Kredit:Dairi T. et al., Journal of the Americ
Ny biosyntetisk vej unik for patogene mikroorganismerDen nyligt opdagede vej involverer to gener, som letter bindingen af L-Glu til UDP-MurNAc-L-Ala og derefter epimeriserer (isomeriserer) L-Glu til D-Glu. Kredit:Dairi T. et al., Journal of the Americ
- Brasilien rapporterer om flere Amazon-brande indtil videre i år end hele 2021
- En ny genetisk prøvetagningsteknik til saltmarskhøstmus og andre små pattedyr
- Undersøgelse peger på globale vandløb og floder, der bidrager til klimaændringer
- Matematisk model hjælper med at forklare C. elegans beslutningsproces
- Apple Watch Series 7:Ny model med større, mere holdbar skærm – tid til en opgradering?
- Peptid-fingeraftryk muliggør tidligere diagnosticering af Alzheimers sygdom


