At finde sprækken i coronavirus-panser - eksperiment afslører, hvordan SARS-CoV-2's vigtigste protease beskytter sig selv
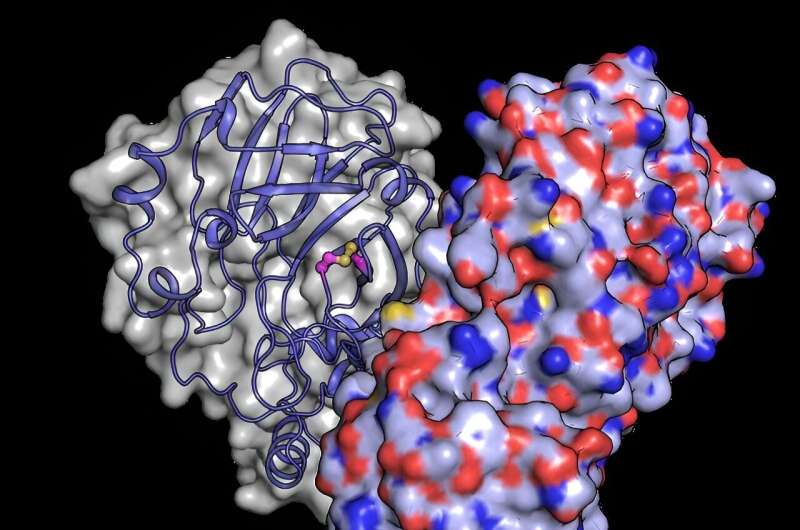
COVID-19-pandemien resulterede i millioner af dødsfald. På trods af en uovertruffen forskningsindsats, der førte til, at effektive vacciner og terapier blev produceret på rekordtid, mangler der stadig en fuldstændig forståelse af strukturen og livscyklussen af coronavirus kendt som SARS-CoV-2.
Forskere brugte biolaboratorierne og SPB/SFX-instrumentet på det europæiske XFEL til at studere virussens hovedprotease eller Mpro for at forstå, hvordan den beskytter sig selv mod oxidativ skade. Resultaterne tilføjer nøgleviden til vores forståelse af SARS-CoV-2's virkemåde og området for viral biologi.
Artiklen er publiceret i tidsskriftet Nature Communications .
Mellem januar 2020 og marts 2023 døde over seks millioner mennesker som følge af luftvejssygdommen COVID-19, og flere hundrede millioner blev smittet. Sygdommen er forårsaget af SARS-CoV-2, en coronavirus.
"Coronavirus er en gruppe RNA-vira, der forårsager sygdomme og sygdomme hos pattedyr og fugle," forklarer den europæiske XFEL-forsker Richard Bean. "På trods af deres betydelige relevans for den globale menneskers sundhed er der dog stadig meget at lære om strukturen og funktionen af coronavirus generelt og SARS-CoV-2 i særdeleshed."
Som svar på udbruddet af pandemien har videnskabsmænd og videnskabelige organisationer over hele kloden gjort en indsats for at studere strukturen, dynamikken og funktionen af SARS-CoV-2 i deres søgen efter vacciner og terapier. På grund af dens centrale rolle i virusets replikationscyklus dukkede hovedproteasen - et enzym, der befrier nyfremstillede stykker af virussen fra hinanden - hurtigt frem som et vigtigt antiviralt lægemiddelmål.
Hovedproteasen, eller Mpro, er særlig attraktiv for lægemiddeludvikling, fordi den spiller en central rolle i viral replikation, og også fordi den er ret forskellig fra alle menneskelige proteiner. Dette gør det muligt for terapier at målrette specifikt mod virussen og samtidig minimere bivirkninger, der kan skade patienter. Tidligere lægemiddelopdagelsesprogrammer rettet mod andre vira har haft held med at bruge virale proteasehæmmere, hvilket gør et vellykket resultat i tilfælde af SARS-CoV-2 mere sandsynligt.
"Selvom højden af COVID-19-pandemien måske er forbi, er der stadig meget værdi i at studere SARS-CoV-2-virussen," siger Thomas Lane fra Center for Free-Electron Laser Science (CFEL) i Hamborg. "COVID fortsætter med at udgøre en betydelig sundhedstrussel på verdensplan. I betragtning af denne viruss persistens og den mulige fremkomst af fremtidige patogene coronavirus er det bydende nødvendigt, at vi udvikler en dybere forståelse af Mpro og dens rolle i viral funktion."
I et nyligt eksperiment ved SPB/SFX-instrumentet på det europæiske XFEL brugte Lane og kolleger den intense røntgenstråle til at studere Mpro. Adskillige tidligere strukturelle undersøgelser med fokus på Mpro har fremhævet en række ejendommeligheder.
"For det første danner proteinet en 3D-struktur kendt som en dimer, når det findes i høje koncentrationer," forklarer den europæiske XFEL-forsker Robin Schubert, som var involveret i eksperimentet. "Denne strukturelle vane ser ud til at påvirke dens aktivitet direkte - men vi ved ikke præcist, hvorfor dette er vigtigt for virussen." Ud over nøgleindsigt i 3D-strukturen har nyere undersøgelser også antydet vigtigheden af cellulære iltniveauer for proteaseaktivitet.
"Det ser ud til, at selv mild eksponering for ilt nedsætter Mpros aktivitet," forklarer Patrick Reinke, også fra CFEL. I nærvær af tilstrækkelig ilt ophører omsætningen faktisk helt. Men denne proces er reversibel - hvis ilten fjernes, reaktiverer enzymet sig selv, hvilket tyder på, at systemet har udviklet beskyttende mekanismer til at overleve i et oxidativt miljø.
"Oxidativ stress har vist sig at regulere funktionen af andre vira, såsom HIV," tilføjer Reinke. "Det er blevet foreslået, at strukturelle ændringer i proteasen lader den undslippe oxidativ skade i iltrige miljøer. Vi er dog stadig usikre på, hvordan disse beskyttelsesmekanismer påvirker viral fitness."
For bedre at forstå, hvordan strukturelle ændringer beskytter proteinet mod iltskader, brugte holdet den europæiske XFELs kraftfulde røntgenstråle til at afsløre strukturen af Mpro, efter at den var blevet udsat for ilt. De opdagede en strukturel omlejring af Mpro, hvor der dannes en binding mellem to cysteinrester:det aktive sted cystein C145 og et distalt cystein C117.
For at opnå dette producerede holdet store mængder Mpro i løbet af flere måneder i biolaboratorierne på European XFEL og forvandlede det til mikrokrystaller, hvoraf nogle blev dyrket i nærvær af oxygen. Til sidst blev mikrokrystallerne sendt flyvende foran den europæiske XFEL-stråle ved SPB/SFX-instrumentet ved hjælp af en væskestråle.
Sådanne små krystaller er umulige at studere ved hjælp af traditionelle lyskilder, fordi mængden af stråling, der er nødvendig for at generere nok data fra krystallerne, ville ødelægge dem. Røntgenimpulserne produceret af det europæiske XFEL er imidlertid så kraftige og korte, at de kan bruges til at tage et billede af proteinkrystallen, før den når at gå i opløsning.
"Vores resultater viser, at det aktive sted cystein, som leder enzymets kemi, snigende kan skjule sig fra oxidativ skade," siger Schubert. Typisk kan oxidation irreversibelt skade cysteiner.
Ved oxidation beskytter Mpro imidlertid dets vigtigste cystein ved at danne det, der er kendt som en "disulfidbinding", som begraver det i kernen af proteinstrukturen. Hvis den derefter flyttes tilbage til et sikkert miljø med lavt iltindhold, kan disulfidbindingen brydes og afsløre det aktive cystein, som genoptager sin oprindelige funktion.
"Eksperimenterne udført på den europæiske XFEL afslører et billede af proteinet i dets skjulte disulfidtilstand, hvilket bekræfter, at det eksisterer og afslører, hvordan det virker," siger Schubert.
"Mpro udviser et usædvanligt rigt sæt af oxidationsmodifikationer, og vores eksperiment tilføjer en nøglebrik til den historie," siger Lane. Forskerne er spændte på, hvad deres data indikerer, og om deres næste skridt. "Mpro er et fundament i coronavirus-biologien og det førende mål for anti-COVID-19 små molekyle terapier.
"Enzymets funktion har vist sig at blive reguleret via både dimerisering og oxidation, og det er klart, at disse reguleringsmekanismer er biofysisk korrelerede. Mens vores strukturer giver mekanistisk indsigt i disse egenskaber ved Mpro, skal vi nu forstå, hvordan regulering baseret på oxidativ stress eller proteinkoncentration påvirker viral fitness Dette vil give dybere indsigt i viral biologi og forhåbentlig åbne nye muligheder for at forstyrre denne biologi med livsbevarende medicin."
Flere oplysninger: Patrick Y. A. Reinke et al, SARS-CoV-2 Mpro reagerer på oxidation ved at danne disulfid- og NOS/SONOS-bindinger, Nature Communications (2024). DOI:10.1038/s41467-024-48109-3
Journaloplysninger: Nature Communications
Leveret af europæiske XFEL
 Varme artikler
Varme artikler
-
 Molekylær struktur forudsagt af den tidlige nobelpristager fundet efter et århundredeKredit:Kilde:Nobelforelæsning af Alfred Werner 11. december, 1913 fra det originale papir nobelprize.org I journalen Natur udgivet natten over, forskere fra Imperial College, London har rapporte
Molekylær struktur forudsagt af den tidlige nobelpristager fundet efter et århundredeKredit:Kilde:Nobelforelæsning af Alfred Werner 11. december, 1913 fra det originale papir nobelprize.org I journalen Natur udgivet natten over, forskere fra Imperial College, London har rapporte -
 Beregningskemi understøtter forskning i nye halvlederteknologierKunstnerens gengivelse af organiske molekyler, der adsorberer på en siliciumoverflade. Kredit:Aaron Beller Efterhånden som nye metoder er blevet tilgængelige til at forstå og manipulere stof på de
Beregningskemi understøtter forskning i nye halvlederteknologierKunstnerens gengivelse af organiske molekyler, der adsorberer på en siliciumoverflade. Kredit:Aaron Beller Efterhånden som nye metoder er blevet tilgængelige til at forstå og manipulere stof på de -
 Lille teknik kan bringe store fremskridt inden for lægehjælpOvenstående grafik viser skemaer for en proces, der er central for forskning ledet af Xiao Wang og Alexander Green for at finde nye måder at genoprette menneskers sundhed ved at ombygge kroppens biome
Lille teknik kan bringe store fremskridt inden for lægehjælpOvenstående grafik viser skemaer for en proces, der er central for forskning ledet af Xiao Wang og Alexander Green for at finde nye måder at genoprette menneskers sundhed ved at ombygge kroppens biome -
 Enkel enhed overvåger sundhed ved hjælp af svedEn multivalve svedopsamler til overvågning af sundhed. Kredit:Jennifer M. McCann/ Penn State En enhed, der overvåger sundhedsmæssige forhold i kroppen ved hjælp af en persons sved, er udviklet af
Enkel enhed overvåger sundhed ved hjælp af svedEn multivalve svedopsamler til overvågning af sundhed. Kredit:Jennifer M. McCann/ Penn State En enhed, der overvåger sundhedsmæssige forhold i kroppen ved hjælp af en persons sved, er udviklet af
- Første operationelle kortlægningssystem til tropiske skovs CO2-emissioner i høj opløsning
- Meget holdbare biomimetiske nanotrough-elektroder til protonudvekslingsmembranbrændselsceller
- BMW investerer en milliard euro i den første fabrik i Ungarn
- Gamle afføring afslører parasitter i 8, 000 år gamle landsby Çatalhöyük
- Leoparder dræber mindst 3 børn i det landlige Indien
- Haumea,


