Forskere karakteriserer præcist styrenoxid-isomerase, som kunne hjælpe med at give grønne kemikalier og lægemiddelprækursorer

Forskere ved Paul Scherrer Institute PSI har - for første gang - præcist karakteriseret enzymet styrenoxid-isomerase, som kan bruges til at producere værdifulde kemikalier og lægemiddelprækursorer på en miljøvenlig måde. Undersøgelsen vises i tidsskriftet Nature Chemistry .
Enzymer er kraftfulde biomolekyler, der kan bruges til at producere mange stoffer under omgivende forhold. De muliggør "grøn" kemi, som reducerer miljøforurening som følge af processer, der anvendes i syntetisk kemi. Et sådant værktøj fra naturen er nu blevet karakteriseret i detaljer af PSI-forskere:enzymet styrenoxid-isomerase. Det er den biologiske version af Meinwald-reaktionen, en vigtig kemisk reaktion i organisk kemi.
"Enzymet, der blev opdaget for årtier siden, er lavet af bakterier," siger Richard Kammerer fra PSI's Biomolecular Research Laboratory. Hans kollega Xiaodan Li tilføjer:"Men fordi dens funktion ikke var kendt, har dens praktiske anvendelse været begrænset indtil nu." De to forskere og deres team har belyst enzymets struktur samt den måde, det virker på.
Simpel mekanisme til en kompliceret reaktion
Mikroorganismer besidder specifikke enzymer, som de for eksempel kan nedbryde skadelige stoffer med og bruge dem som næringsstoffer. Styrenoxidisomerase er en af disse. Sammen med to andre enzymer gør det det muligt for visse miljøbakterier at vokse på kulbrintestyrenet.
Styrenoxid-isomerasen katalyserer et meget specifikt trin i reaktionen:Den spalter en treleddet ring i styrenoxidet bestående af et oxygen- og to kulstofatomer, et såkaldt epoxid. Derved er enzymet meget specifikt og skaber kun ét produkt. Det er også i stand til at omdanne en række yderligere stoffer, hvilket producerer vigtige prækursorer til medicinske anvendelser.
En særlig fordel hænger sammen med, at der i mange kemiske reaktioner dannes både et billede og et spejlbillede af en kemisk forbindelse, som kan have helt forskellige biologiske effekter. Men dette enzym skaber specifikt kun ét af de to produkter. I kemi kaldes denne egenskab for stereospecificitet - den er særlig vigtig for dannelsen af prækursormolekyler til lægemidler.
"Enzymet er et imponerende eksempel på, hvordan naturen muliggør kemiske reaktioner på en enkel og genial måde," siger Li.
I løbet af deres undersøgelser, som de delvist udførte på Swiss Light Source SLS, opdagede PSI-forskerne enzymets hemmelighed:en jernholdig gruppe i dets indre, der ligner det jernholdige pigment i vores røde blodlegemer. Denne hæmgruppe binder epoxidringen, og det er sådan den gør reaktionen så enkel og effektiv.
Andre dele af undersøgelserne blev udført af gruppen af Volodymyr Korkhov, også fra PSI Laboratory for Biomolecular Research og lektor ved Institut for Biologi ved ETH Zürich, ved hjælp af kryo-elektronmikroskopi.
Li og Kammerer føler sig sikre på, at enzymet vil vise sig yderst nyttigt i den kemiske og farmaceutiske industri. "Det er indtil videre det eneste bakterielle enzym, der er kendt for at katalysere Meinwald-reaktionen," understreger Kammerer. Med enzymets hjælp kunne industrien producere prækursorer til lægemidler og vigtige kemikalier under energibesparende og miljøvenlige forhold.
Li tilføjer:"Enzymet kan potentielt ændres, så det kan producere rigtig mange nye stoffer."
Derudover er enzymet meget stabilt og er derfor velegnet til store industrielle anvendelser.
"Det vil helt sikkert blive et nyt, vigtigt værktøj for den cirkulære økonomi og grøn kemi," er PSI-forskerne overbevist.
Flere oplysninger: Strukturelt grundlag for Meinwald-omlejringen katalyseret af styrenoxid-isomerase, Nature Chemistry (2024). DOI:10.1038/s41557-024-01523-y
Journaloplysninger: Naturkemi
Leveret af Paul Scherrer Institute
 Varme artikler
Varme artikler
-
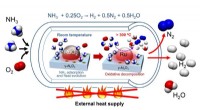 Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford
Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford -
 En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig -
 Låser op for mysteriet med katalysatorerPlatin er tidligere blevet brugt til katalyseopgaver, men det er dyrt, hovedsagelig på grund af dens knaphed og også på grund af den minedrift, der kræves for at få den. Platinkatalyse kan også give u
Låser op for mysteriet med katalysatorerPlatin er tidligere blevet brugt til katalyseopgaver, men det er dyrt, hovedsagelig på grund af dens knaphed og også på grund af den minedrift, der kræves for at få den. Platinkatalyse kan også give u -
 Alginsyre forbedrer kunstige knoglerTværsnitsmikrostrukturer i de indstillede CPC-prøver (a) uden og (b) med alginat (20 vægt%). Lidt porøsitet blev påvist i CPC-prøve uden alginat (a1). Tilsætning af alginat resulterede i dannelsen af
Alginsyre forbedrer kunstige knoglerTværsnitsmikrostrukturer i de indstillede CPC-prøver (a) uden og (b) med alginat (20 vægt%). Lidt porøsitet blev påvist i CPC-prøve uden alginat (a1). Tilsætning af alginat resulterede i dannelsen af
- Sådan beregnes tiden for Cell Doubling
- Ændringer af dyrefoder kan levere mad til 1 milliard mennesker
- Formindskelse af et kemikalies kulstofaftryk i hverdagsgenstande
- Hvad hvis du spiste uran?
- Team -afkodet molekylær mekanisme, der hæmmer sværmende motilitet hos bakteriepopulationer
- Tidlig global drivhusbegivenhed gav anledning til brandtilpassede træer


