Ny tidsopløst ultraviolet fotodissociationsmassespektrometristrategi til målproteinstabilitetsanalyse

Hvordan mutationer påvirker proteinstabilitet og strukturdynamik er afgørende for at forstå sygdommens molekylære mekanisme og det målrettede lægemiddeldesign. Det er dog stadig udfordrende at undersøge de molekylære detaljer i mutationsinduceret subtil strukturdynamik.
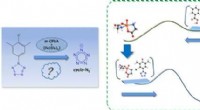
En forskergruppe ledet af prof. Wang Fangjun fra Dalian Institute of Chemical Physics (DICP) under det kinesiske videnskabsakademi har udviklet en tidsopløst native massespektrometri (TR-nMS) strategi kombineret med ultraviolet fotodissociation (UVPD) analyse. Denne strategi kan undersøge de mutationsinducerede subtile ændringer i proteinstabilitet og strukturudfoldelsesdynamik. Undersøgelsen er offentliggjort i Journal of the American Chemical Society .
Forskerne startede proteinudfoldningsprocessen ved at blande proteinet online med myresyre. Med nativ massespektrometri (nMS) og ikke-denaturerende elektrospray-ionisering (nESI) overvågede de arterne og relative intensiteter af syre-initierede protein-udfoldende mellemprodukter via de unikke ladningstilstandsfordelinger (CSD'er), og de karakteriserede kvantitativt M42T/H114R-mutationerne inducerede stabilitetsændringer af målproteiner.
Derudover brugte forskerne UVPD- og fragmentionmassespektrometrimetoder til kvantitativt at sammenligne den dynamiske struktur og molekylære detaljer af de udfoldende mellemprodukter af vildtype dihydrofolatreduktase (DHFR) og mutanten.
UVPD-analysen afslørede den særlige stabiliseringseffekt af cofaktor nikotinamid adenindinukleotidphosphat (NADPH) på DHFR-strukturen, og at M42T/H114R-mutationerne kunne reducere de ikke-kovalente NADPH-DHFR-interaktioner, herunder rest I41, Q65, V78, D79, I , og R98, hvilket fremmer et fald i stabilitet.
"Dette arbejde giver en ny teknik til at studere den mutationsinducerede subtile strukturdynamik og patologiske mekanismer," sagde prof. Wang.
Flere oplysninger: Pan Luo et al., Time-Resolved Ultraviolet Photodissociation Mass Spectrometry Probes the Mutations-induced Changes in Protein Stability and Unfolding Dynamics, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.4c00316
Journaloplysninger: Tidsskrift for American Chemical Society
Leveret af Chinese Academy of Sciences
 Varme artikler
Varme artikler
-
 Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid:
Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid: -
 En måde at øge strukturel stabilitet i anstrengte halogenidperovskitteren, Optiske billeder af de voksende epitaksiale α-FAPbI3 tynde film. Den høje gennemsigtighed af substraterne og de glatte overflader af de tynde film demonstrerer deres høje kvalitet. Målestænger, 4
En måde at øge strukturel stabilitet i anstrengte halogenidperovskitteren, Optiske billeder af de voksende epitaksiale α-FAPbI3 tynde film. Den høje gennemsigtighed af substraterne og de glatte overflader af de tynde film demonstrerer deres høje kvalitet. Målestænger, 4 -
 Forskere optrævler syntetisk mekanisme for arylpentazol og substituenteffekthttps://doi.org/10.1021/acs.jpclett.9b03762 Copyright © 2020 American Chemical Society For nylig, et forskerhold ledet af prof. Liu Jianyong og prof. Han Keli fra Dalian Institute of Chemical Phys
Forskere optrævler syntetisk mekanisme for arylpentazol og substituenteffekthttps://doi.org/10.1021/acs.jpclett.9b03762 Copyright © 2020 American Chemical Society For nylig, et forskerhold ledet af prof. Liu Jianyong og prof. Han Keli fra Dalian Institute of Chemical Phys -
 Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen
Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen
- Sådan beregnes PPM
- Forskere udspionerer nye beviser for vand i månens indre
- Eksplosion i Beirut:Katastrofen var usædvanlig, men begivenheder, der førte til den, var det ikke,…
- Blev alle påvirket af mennesker i vores netværk - hvordan man gør dette til en kraft for det gode
- Ny analyse finder muligheder for kulstoffangst, opbevaring
- Europa og afrikanske forbindelser efter COVID-19:Tid til at tilføje størrelse, skala og hastighed


