Et klarere billede af glaukom:Forholdet mellem udfoldelse og aggregering for glaukom-associeret myocilin
Fra Parkinsons og Alzheimers til hjertearytmi er amyloider forbundet med en række sygdomme. Disse aggregater af proteiner dannes i kroppen, når et protein mister sin normale struktur og fejlfolder eller muterer. Og da mange af disse proteiner er store og komplicerede, er det stadig et mysterium, hvordan nogle af disse mutationer opstår og aggregeres – og det samme gør skabelsen af effektive behandlinger.
Ny forskning om glaukom ledet af Georgia Tech-kemikere og en alumne kan hjælpe med at ændre det.
"Der er blevet gjort en masse arbejde for at forstå, hvordan mindre foldede proteiner danner amyloidaggregater, men denne undersøgelse hjælper os med at forstå aggregeringsvejen for et større, mere komplekst system," siger medforfatter Emily Saccuzzo. Det arbejde kunne en dag hjælpe videnskabsmænd med at afdække nye behandlingsformer – ikke kun for grøn stær, men også for andre sygdomme forårsaget af proteinaggregation.
Saccuzzo startede projektet i 2018 som kandidatstuderende i Lieberman Lab i School of Chemistry and Biochemistry ved Georgia Tech og er nu en postdoktoral forskningsassistent ved Pacific Northwest National Labs.
"Emily var sommerstuderende, før hun blev immatrikuleret, og hun etablerede den indledende gennemførlighed af at udføre disse eksperimenter," siger Raquel Lieberman, professor og Sepcic Pfeil Chair i Kemi ved Georgia Tech. "Jeg er enormt stolt af hende."
Deres forskerholds nylige resultater er omtalt i et papir, "Konkurrence mellem udfoldelse indefra og ud og patogen aggregering i en amyloiddannende β-propel," offentliggjort i tidsskriftet Nature Communications .
Lieberman og Saccuzzo samlede forskere fra hele og uden for instituttet for at samarbejde om undersøgelsen.
"Dette var et meget tværfagligt projekt, og det er altid virkelig tilfredsstillende," siger Lieberman. "Jeg tror, at når du bringer flere mennesker til bordet, kan du svare på svære spørgsmål og gøre mere, end du kan gøre på egen hånd."
Et kompliceret protein
Mens mange undersøgelser har fokuseret på mindre proteiner, kaldet modelproteiner, der har etableret 'regler' og kendte mønstre for amyloiddannelse (en specialiseret type proteinaggregering), er proteinet, der bidrager til glaukom, større og mere komplekst. Denne type større, kompliceret protein er relativt ustuderet.
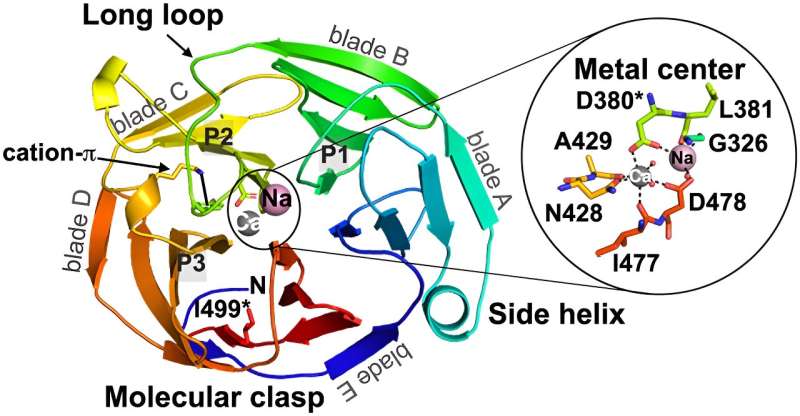
"Vi havde i et stykke tid vidst, at mutationer i myocilin kan forårsage, at proteinet fejlfolder og aggregerer, hvilket igen fører til glaukom," siger Saccuzzo. "Hvad vi dog ikke vidste, var den nøjagtige mekanisme, hvorved dette protein fejlfolder og aggregeres."
"Målet med denne undersøgelse var at bestemme, hvordan sygdomsmutanter fejlfoldes, i håb om, at det ville give os indsigt i de tidlige trin i aggregeringsvejen," tilføjer hun.
Placeret ved grænsefladen mellem det hvide i øjet og den farvede iris danner proteinet en lille lille ring hele vejen rundt om øjet.
"Hver gang du blinker, strækker du den muskel. Hver gang vinden blæser virkelig stærkt, eller du får noget i øjet. Hver gang du gnider dit øje, kan du påvirke dette protein - selv når det ikke forårsager sygdom," Lieberman siger.
Alligevel er forskerne ikke sikre på, hvad proteinet gør. "Vi ved kun, hvad det gør, når det giver problemer," som glaukom, forklarer hun. "Vi ved ikke, hvad dens faktiske biologiske funktion er."
Lieberman var oprindeligt tiltrukket af ideen om at studere proteinet, fordi hun spekulerede på, om forskningen i modelproteinerne kunne anvendes på det protein, der forårsager glaukom.
"De virkelig tidlige undersøgelser viste, at det sandsynligvis lignede disse modelproteiner, der danner amyloid," siger Lieberman. "Jeg ville undersøge det, for hvis vi kunne vise, at det var sandt, så kunne vi udnytte de fantastiske ressourcer og forskning, der er udført på modelsystemer for at hjælpe os med at bekæmpe sygdommen."
Et uforudsigeligt system
"Dette var et af de største amyloiddannende proteiner karakteriseret til dato," siger Saccuzzo, og mens holdet håbede, at de ville finde ligheder med modelproteiner, viste det større glaukom-associerede protein øget kompleksitet.
"Jeg tror, at en af de mest overraskende observationer, vi har lavet, er, at proteinet i sig selv ikke er i ligevægt i omkring 90 dage efter det er lavet," tilføjer Lieberman. "En af principperne i proteinkemi er, at aminosyresekvenser antager en unik struktur, og at al den information, der er nødvendig for at folde proteinet ind i dets 3D-struktur, opbevares i den aminosyresekvens."
Her sprang proteinet en lille mængde, hvilket betyder, at det ikke var i ligevægt. "Der sker så meget mere i systemet, end nogen kunne have forestillet sig," forklarer Lieberman. "Vi antager, at formen styrer nogle af egenskaberne, men dette er endnu et mysterium ved dette protein."
Fordi proteinet er så kompliceret og ikke er i ligevægt, "er der en lang liste over de ting, vi ikke kan forudsige," siger Lieberman og tilføjer, at det gør computerforudsigelser vanskelige sammen med visse eksperimenter. "Det var et øjeblik, hvor vi tænkte:wow, her er det her nye system, som folk burde tænke over. Reglerne kan blive forfinet for at hjælpe os med bedre at forstå, hvad der foregår."
Fremtiden for proteinmodellering
Mens yderligere forskning skal udføres for at bestemme, hvordan man bedst behandler glaukom, giver undersøgelsen et kritisk grundlag for fremtidige undersøgelser. "Det, der ikke er klart for mig lige nu, er, om vi ville være i stand til at finde ét lægemiddel til alle de mennesker, der har mutationer, eller om vi har brug for et specifikt lægemiddel for hver type mutation, vi ville støde på," siger Lieberman. P>
Selvom forskningen ikke beviser, at én behandling måske ikke er effektiv for alle, "viser den bestemt, at der er meget mere i dette system, end vi nogensinde havde forventet."
"At forstå, hvordan sygdomsmutanter ser ud på molekylært niveau, kan hjælpe med at bane vejen for strukturelt specifikke glaukom-terapier og diagnostiske værktøjer," tilføjer Saccuzzo.
Lieberman og Saccuzzo understreger også, at arbejdet med at forstå det protein, der er ansvarligt for glaukom, også kan anvendes på andre store proteiner.
"I slutningen af dagen er flere proteiner ikke modelproteiner end modelproteiner," siger Lieberman.
"Der er mange flere systemer derude, og jeg formoder, at der er mange flere proteiner, der kan aggregere og kan bidrage til sygdom eller aldring, som endnu ikke er blevet udforsket. Jeg tror, denne forskning viser værdien af at bringe mange forskellige tilgange til sondering. et kompliceret system for at lære mere om det."
Flere oplysninger: Emily G. Saccuzzo et al., Konkurrence mellem udfoldelse indefra og ud og patogen aggregering i en amyloiddannende β-propel, Nature Communications (2024). DOI:10.1038/s41467-023-44479-2
Journaloplysninger: Nature Communications
Leveret af Georgia Institute of Technology
 Varme artikler
Varme artikler
-
 Aktivering af synligt lys muliggør transformation af bordstabile sulfoner til værdifulde glykoside…Skematisk, der viser designet af et synligt lys-medieret system til at krydskoble forskellige elektrofiler med glycosylradikaler afledt af bench-stabile heteroarylsulfoner. Kredit:Nature Synthesis (20
Aktivering af synligt lys muliggør transformation af bordstabile sulfoner til værdifulde glykoside…Skematisk, der viser designet af et synligt lys-medieret system til at krydskoble forskellige elektrofiler med glycosylradikaler afledt af bench-stabile heteroarylsulfoner. Kredit:Nature Synthesis (20 -
 Ny indsigt i bakterielle toksinerEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Et toksin produceret af en bakterie, der forårsager urinvejsinfektioner, er relateret til, dog anderledes på vigtige måder fra, gif
Ny indsigt i bakterielle toksinerEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Et toksin produceret af en bakterie, der forårsager urinvejsinfektioner, er relateret til, dog anderledes på vigtige måder fra, gif -
 Skyerne af spaghetti, der holder DNA-data sikreForskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David
Skyerne af spaghetti, der holder DNA-data sikreForskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David -
 Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne
Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne
- Norge ansporer 400 millioner dollars til regnskovsfond i Davos
- Ukonventionel teknologi forbedrer kompositmaterialer, der er vigtige for bil-, rumfarts- og vedvaren…
- Den store orkan Juliettes dukker op, set i NASA-satellitbilleder
- Klimaet af Vådlandsskov Økosystemer
- Højskoleelever slutter sig til lærde for at løfte låget på Hongkongs jordbiodiversitet
- Matematik med lysets hastighed


