Forskere tæmmer kaotisk protein, der giver næring til 75 % af kræfttilfældene
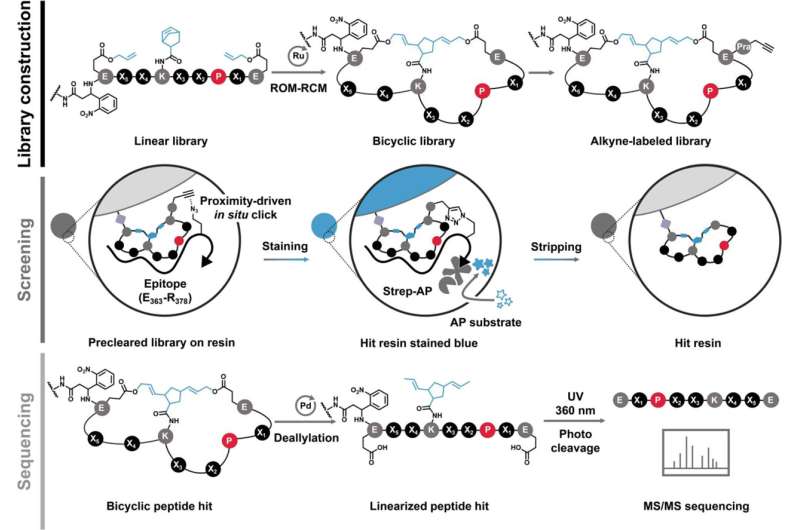
MYC er det formløse protein, der er ansvarligt for at gøre størstedelen af menneskelige kræfttilfælde værre. UC Riverside-forskere har fundet en måde at tøjle det på og giver håb om en ny æra af behandlinger.
I raske celler hjælper MYC med at guide transkriptionsprocessen, hvor genetisk information omdannes fra DNA til RNA og i sidste ende til proteiner. "Normalt er MYC's aktivitet strengt kontrolleret. I kræftceller bliver den hyperaktiv og reguleres ikke ordentligt," sagde UCR lektor i kemi Min Xue.
"MYC er mindre som mad til kræftceller og mere som et steroid, der fremmer kræftens hurtige vækst," sagde Xue. "Det er grunden til, at MYC er en synder i 75 % af alle kræfttilfælde hos mennesker."
I begyndelsen af dette projekt troede UCR-forskerholdet, at hvis de kunne dæmpe MYC's hyperaktivitet, kunne de åbne et vindue, hvor kræften kunne kontrolleres.
Det var imidlertid en udfordring at finde en måde at kontrollere MYC på, fordi i modsætning til de fleste andre proteiner har MYC ingen struktur. "Det er dybest set en glob af tilfældighed," sagde Xue. "Konventionelle pipelines til opdagelse af lægemidler er afhængige af veldefinerede strukturer, og dette eksisterer ikke for MYC."
En ny artikel i Journal of the American Chemical Society , hvor Xue er ledende forfatter, beskriver en peptidforbindelse, der binder til MYC og undertrykker dens aktivitet.
I 2018 bemærkede forskerne, at ændring af et peptids stivhed og form forbedrer dets evne til at interagere med strukturløse proteinmål såsom MYC.
"Peptider kan antage en række forskellige former, former og positioner," sagde Xue. "Når du først bøjer og forbinder dem til at danne ringe, kan de ikke antage andre mulige former, så de har et lavt niveau af tilfældighed. Dette hjælper med bindingen."
I papiret beskriver holdet et nyt peptid, der binder direkte til MYC med det, der kaldes sub-mikro-molær affinitet, som kommer tættere på styrken af et antistof. Det er med andre ord en meget stærk og specifik interaktion.
"Vi forbedrede bindingsydelsen af dette peptid i forhold til tidligere versioner med to størrelsesordener," sagde Xue. "Dette gør det tættere på vores lægemiddeludviklingsmål."
I øjeblikket bruger forskerne lipid-nanopartikler til at levere peptidet til celler. Det er små kugler lavet af fede molekyler, og de er ikke ideelle til brug som lægemiddel. Fremover er forskerne ved at udvikle kemi, der forbedrer blypeptidets evne til at komme ind i cellerne.
Når peptidet er i cellen, vil det binde til MYC, hvilket ændrer MYC's fysiske egenskaber og forhindrer det i at udføre transkriptionsaktiviteter.
Xues laboratorium på UC Riverside udvikler molekylære værktøjer til bedre at forstå biologi og bruger den viden til at udføre lægemiddelopdagelse. Han har længe været interesseret i kaotiske processers kemi, hvilket tiltrak ham udfordringen med at tæmme MYC.
"MYC repræsenterer kaos, dybest set, fordi det mangler struktur. Det og dets direkte indvirkning på så mange typer kræft gør det til en af de hellige grale af udvikling af kræftlægemidler," sagde Xue. "Vi er meget glade for, at det nu er inden for vores rækkevidde."
Flere oplysninger: Zhonghan Li et al, MYC-targeting inhibitors genereret fra et stereodiversificeret bicyklisk peptidbibliotek, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c09615
Journaloplysninger: Tidsskrift for American Chemical Society
Leveret af University of California - Riverside
 Varme artikler
Varme artikler
-
 Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l
Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l -
 Forskere får indsigt i, hvordan enzymer opnår specifikke reaktionerSkematisk illustration af de afgørende roller af Glu76-rest i Ni-QueD. Kredit:Prof. LIs gruppe Katalytisk dioxygenaktivering og selektiv oxidativ spaltning af C-C-bindinger er blevet forsknings-ho
Forskere får indsigt i, hvordan enzymer opnår specifikke reaktionerSkematisk illustration af de afgørende roller af Glu76-rest i Ni-QueD. Kredit:Prof. LIs gruppe Katalytisk dioxygenaktivering og selektiv oxidativ spaltning af C-C-bindinger er blevet forsknings-ho -
 Genbrug og genbrug af slidte katoder til at lave nye lithium-ion-batterierBrugte katodepartikler fra brugte lithium-ion-batterier genbruges og regenereres, så de fungerer så godt som nye. Kredit:David Baillot/UC San Diego Jacobs School of Engineering Nanoingeniører ved
Genbrug og genbrug af slidte katoder til at lave nye lithium-ion-batterierBrugte katodepartikler fra brugte lithium-ion-batterier genbruges og regenereres, så de fungerer så godt som nye. Kredit:David Baillot/UC San Diego Jacobs School of Engineering Nanoingeniører ved -
 Supersmøreevne i mikroskala kan bane vejen for fremtidige forbedrede elektromekaniske enhederKredit:CC0 Public Domain Smøreevne måler reduktionen i mekanisk friktion og slid af et smøremiddel. Disse er hovedårsagerne til komponentfejl og energitab i mekaniske og elektromekaniske systemer.
Supersmøreevne i mikroskala kan bane vejen for fremtidige forbedrede elektromekaniske enhederKredit:CC0 Public Domain Smøreevne måler reduktionen i mekanisk friktion og slid af et smøremiddel. Disse er hovedårsagerne til komponentfejl og energitab i mekaniske og elektromekaniske systemer.
- Undersøgende rapport kaster lys over filantropiske fondes brug af offshore-investeringer til at rej…
- Undersøgelse viser, at plantehydraulik skaber streaming elektrisk potentiale synkroniseret med biol…
- Når et jordskælv rammer, hvordan reagerer Mexico city hospitaler?
- Kæledyrspapegøjer foretrækker live videoopkald frem for at se forudindspillede videoer af andre f…
- Nanozymer - effektiv modgift mod pesticider
- Billede:Hubble ser en fjern galakse gennem en kosmisk linse


