Forskerhold opdager, hvordan man saboterer antibiotika-resistente superbugs
Antibiotika-resistente "superbugs", der kan besejre bestræbelserne på at dræbe dem, er en presserende folkesundhedskrise, og ifølge Centers for Disease Control forekommer mere end 2,8 millioner antibiotika-resistente infektioner hvert år. Forskere over hele verden kæmper for at klare udfordringen.
Et samarbejdende team af forskere ledet af University of Massachusetts Amherst og inklusive forskere fra det biofarmaceutiske firma Microbiotix meddelte for nylig, at de med succes havde lært, hvordan man saboterer et vigtigt stykke maskineri, som patogener bruger til at inficere deres værtsceller, og har udviklet en test til identificere næste generations lægemidler til at målrette dette sårbare cellulære maskineri og opnå reelle gevinster i folkesundheden.
Den typiske strategi ved behandling af mikrobielle infektioner er at sprænge patogenet med et antibiotisk lægemiddel, som virker ved at komme ind i den skadelige celle og dræbe den. Dette er ikke så let, som det lyder, fordi ethvert nyt antibiotikum skal både være vandopløseligt, så det nemt kan bevæge sig gennem blodbanen, og fedtet, for at krydse den patogene celles første forsvarslinje, cellemembranen. Vand og olie blandes selvfølgelig ikke, og det er svært at designe et lægemiddel, der har nok af begge egenskaber til at være effektivt.
Vanskeligheden stopper heller ikke der, fordi patogene celler har udviklet noget, der kaldes en "udstrømningspumpe", der kan genkende antibiotika og derefter sikkert udskille dem fra cellen, hvor de ikke kan gøre nogen skade. Hvis antibiotikummet ikke kan overvinde effluxpumpen og dræbe cellen, så "husker" patogenet, hvordan det specifikke antibiotikum ser ud og udvikler yderligere effluxpumper til effektivt at håndtere det – i realiteten bliver det resistent over for det pågældende antibiotikum.
En vej frem er at finde et nyt antibiotikum eller kombinationer af dem og prøve at være et skridt foran superbugs.
"Eller vi kan ændre vores strategi," siger Alejandro Heuck, lektor i biokemi og molekylærbiologi ved UMass Amherst og avisens seniorforfatter. "Jeg er kemiker, og jeg har altid været meget interesseret i at forstå, hvordan kemiske molekyler interagerer med levende organismer. Jeg har især fokuseret min forskning på de molekyler, der muliggør kommunikation mellem et patogen og den værtscelle, det ønsker at invadere."
Heuck og hans kolleger har været særligt interesserede i et kommunikationssystem kaldet Type 3-sekretionssystemet, som indtil videre ser ud til at være en evolutionær tilpasning, der er unik for patogene mikrober.
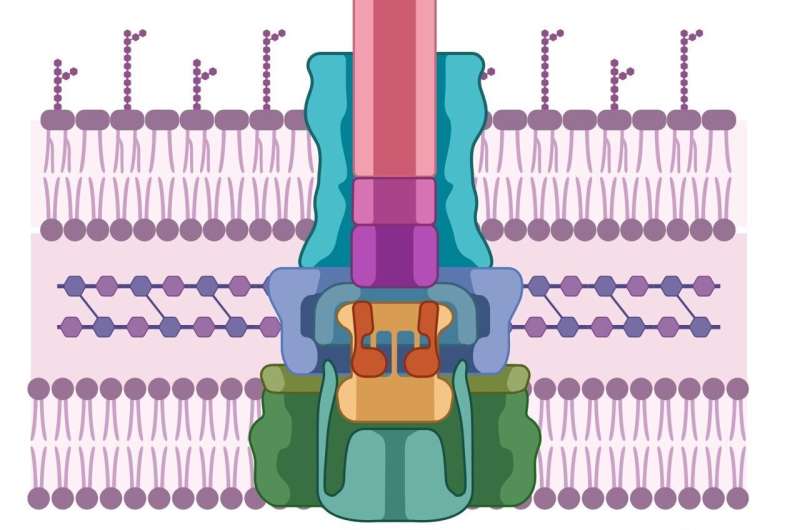
Ligesom den patogene celle har værtsceller også tykke, svært gennemtrængelige cellevægge. For at bryde dem har patogener udviklet en sprøjte-lignende maskine, der først udskiller to proteiner, kendt som PopD og PopB. Hverken PopD eller PopB kan individuelt bryde cellevæggen, men de to proteiner kan sammen skabe et "translokon" - den cellulære ækvivalent af en tunnel gennem cellemembranen. Når tunnelen er etableret, kan den patogene celle injicere andre proteiner, der gør arbejdet med at inficere værten.
Hele denne proces kaldes Type 3-sekretionssystemet - og intet af det virker uden både PopB og PopD. "Hvis vi ikke forsøger at dræbe patogenet," siger Heuck, "så er der ingen chance for, at det udvikler resistens. Vi saboterer bare dens maskine. Patogenet er stadig i live; det er bare ineffektivt, og værten har tid at bruge sit naturlige forsvar til at slippe af med patogenet."
Spørgsmålet er så, hvordan man finder det molekyle, der kan blokere samlingen af translokonet?
Nogle gange kommer der løsninger til videnskabsmænd i de "pæreøjeblikke", hvor alting pludselig giver mening. I dette tilfælde var det mere et lyn-bug-øjeblik.
Heuck og hans kolleger indså, at en enzymklasse kaldet luciferaserne - svarende til dem, der får lynet til at lyse om natten - kunne bruges som sporstof. De deler enzymet i to halvdele. Den ene halvdel gik ind i PopD/PopB-proteinerne, og den anden halvdel blev manipuleret til en værtscelle.
Disse konstruerede proteiner og værter kan oversvømmes med forskellige kemiske forbindelser. Hvis værtscellen pludselig lyser op, betyder det, at PopD/PopB med succes brød cellevæggen og genforenede de to halvdele af luciferasen, hvilket fik dem til at gløde. Men hvis cellerne forbliver mørke? "Så ved vi, hvilke molekyler der bryder translokonet," siger Heuck.
Heuck er hurtig til at påpege, at hans teams forskning ikke kun har åbenlyse anvendelser i verden af lægemidler og folkesundhed, men at den også fremmer vores forståelse af præcis, hvordan mikrober inficerer sunde celler. "Vi ville undersøge, hvordan patogener virkede," siger han, "og så opdagede vi pludselig, at vores resultater kan hjælpe med at løse et folkesundhedsproblem."
Denne forskning er publiceret i tidsskriftet ACS Infectious Diseases .
Flere oplysninger: Hanling Guo et al., cellebaseret assay til bestemmelse af type 3-sekretionssystem-translokonsamling i Pseudomonas aeruginosa ved brug af split luciferase, ACS-infektionssygdomme (2023). DOI:10.1021/acsinfecdis.3c00482
Journaloplysninger: ACS-infektionssygdomme
Leveret af University of Massachusetts Amherst
 Varme artikler
Varme artikler
-
 Brug af elektricitet til at skabe forbindelser til lægemidler, andre kemikalierKredit:CC0 Public Domain Hvad har krudt, penicillin og teflon til fælles? De var opfindelser, der tog verden med storm, men de blev alle skabt ved et fuldstændigt tilfælde. I en ny undersøgelse of
Brug af elektricitet til at skabe forbindelser til lægemidler, andre kemikalierKredit:CC0 Public Domain Hvad har krudt, penicillin og teflon til fælles? De var opfindelser, der tog verden med storm, men de blev alle skabt ved et fuldstændigt tilfælde. I en ny undersøgelse of -
 Når menneske og maskine er enige om iridiumoxidKredit:CC0 Public Domain Et menneskeligt forskerhold og en maskinlæringsalgoritme har fundet ud af, at vi er nødt til at genoverveje meget af det, vi ved om iridiumoxid. Iridiumoxid er en fremrag
Når menneske og maskine er enige om iridiumoxidKredit:CC0 Public Domain Et menneskeligt forskerhold og en maskinlæringsalgoritme har fundet ud af, at vi er nødt til at genoverveje meget af det, vi ved om iridiumoxid. Iridiumoxid er en fremrag -
 Sniffing af frugtagtige thioler i hoppede ølKredit:American Chemical Society Hoppy øl som blege øl bliver stadig mere populære. En grund er deres behagelige frugtagtige aroma, der delvist stammer fra forbindelser kaldet thioler. Bryggerier
Sniffing af frugtagtige thioler i hoppede ølKredit:American Chemical Society Hoppy øl som blege øl bliver stadig mere populære. En grund er deres behagelige frugtagtige aroma, der delvist stammer fra forbindelser kaldet thioler. Bryggerier -
 Personlige kræftvacciner:Leveringsgennembrud kan give bedre resultaterKredit:Ecole Polytechnique Federale de Lausanne Den eneste terapeutiske cancervaccine på markedet har indtil videre vist meget begrænset effekt i kliniske forsøg. EPFL-forskere arbejder i øjeblikk
Personlige kræftvacciner:Leveringsgennembrud kan give bedre resultaterKredit:Ecole Polytechnique Federale de Lausanne Den eneste terapeutiske cancervaccine på markedet har indtil videre vist meget begrænset effekt i kliniske forsøg. EPFL-forskere arbejder i øjeblikk
- Ødelæggelse af et atlantisk regnskovsfragment øger den lokale temperatur
- Sådan løses et aritmetisk sekvensproblem med variabel betingelse
- I kølvandet på skovbrande og coronavirus, det er på tide, vi taler om menneskelig sikkerhed
- UKs Modern Slavery Act udfordrende for universiteter
- Ekstra-tropisk cyklon Harold fanget af Terra Satellite
- Kan aminosyrer også udvikles som pesticid mod plantevirus?


