Hvad er der i en isotop? Ganske meget
Atomnummer
Et grundstofs atomnummer er antallet af protoner i dets kerne. Dette nummer er unikt for hvert grundstof og bestemmer dets kemiske egenskaber. For eksempel er alle atomer med en proton brintatomer, alle atomer med to protoner er heliumatomer og så videre.
Massenummer
Et grundstofs massetal er det samlede antal protoner og neutroner i dets kerne. Dette nummer er også unikt for hvert element og bestemmer dets fysiske egenskaber. For eksempel har den mest almindelige isotop af kulstof seks protoner og seks neutroner, hvilket giver den et massetal på 12.
Isotoper
Isotoper af et grundstof har samme atomnummer, men forskellige massetal. Dette skyldes, at de har det samme antal protoner, men forskellige antal neutroner. For eksempel har kulstof tre naturligt forekommende isotoper:kulstof-12, kulstof-13 og kulstof-14. Alle disse isotoper har seks protoner, men kulstof-12 har seks neutroner, kulstof-13 har syv neutroner, og kulstof-14 har otte neutroner.
Radioaktive isotoper
Nogle isotoper er radioaktive, hvilket betyder, at de henfalder til andre grundstoffer over tid. Denne henfaldsproces frigiver energi, som kan bruges til en række forskellige formål, såsom at generere elektricitet, drive rumfartøjer og behandle kræft. For eksempel bruges isotopen uranium-235 som brændstof i atomreaktorer, og isotopen jod-131 bruges til at behandle kræft i skjoldbruskkirtlen.
Anvendelser af isotoper
Isotoper har en bred vifte af anvendelser inden for videnskab, medicin og industri. For eksempel bruges isotoper til:
* Dato arkæologiske artefakter
* Undersøg livets udvikling
* Diagnosticere og behandle sygdomme
* Spor bevægelsen af forurenende stoffer
* Udvikle nye materialer
Konklusion
Isotoper er fascinerende og vigtige elementer i den naturlige verden. De har en bred vifte af applikationer og kan lære os meget om universet omkring os.
Sidste artikelForskere opdager, hvordan vi registrerer sur smag
Næste artikelHeliumkrystaller af høj kvalitet viser supersolid adfærd
 Varme artikler
Varme artikler
-
 Video:Jordens små skraldefolk?Kredit:The American Chemical Society Hvis du nyder noget velsmagende mad i dag, der har mindst én ingrediens, der blev dyrket et sted, du skylder sandsynligvis lidt takket være regnorme. Hvordan
Video:Jordens små skraldefolk?Kredit:The American Chemical Society Hvis du nyder noget velsmagende mad i dag, der har mindst én ingrediens, der blev dyrket et sted, du skylder sandsynligvis lidt takket være regnorme. Hvordan -
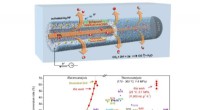 Ny sølv hulfiber booster CO2-elektroreduktionSkematisk illustration af hulfiberelektrode til at øge CO2-reduktionen til CO. Kredit:SARI Et forskerhold ledet af Profs. Wei Wei og Chen Wei fra Shanghai Advanced Research Institute (SARI) fra det
Ny sølv hulfiber booster CO2-elektroreduktionSkematisk illustration af hulfiberelektrode til at øge CO2-reduktionen til CO. Kredit:SARI Et forskerhold ledet af Profs. Wei Wei og Chen Wei fra Shanghai Advanced Research Institute (SARI) fra det -
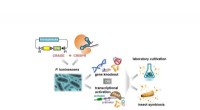 Udtrækning af hemmeligheder bag sekundære metabolitterVed at kombinere CRAGE- og CRISPR-teknologier har forskerne en meget nemmere metode til at karakterisere sekundære metabolitter. Kredit:Cell Chemical Biology (2021). DOI:10.1016/j.chembiol.2021.08.009
Udtrækning af hemmeligheder bag sekundære metabolitterVed at kombinere CRAGE- og CRISPR-teknologier har forskerne en meget nemmere metode til at karakterisere sekundære metabolitter. Kredit:Cell Chemical Biology (2021). DOI:10.1016/j.chembiol.2021.08.009 -
 Biokompatible fotoniske krystaller udvider applikationer fra optik til medicinKredit:ITMO University Forskere ved ITMO University har udviklet en ny tilgang til at opnå ikke-toksiske magnetiske fotoniske krystaller, udvide deres applikationer fra fotonik til biomedicin. Nan
Biokompatible fotoniske krystaller udvider applikationer fra optik til medicinKredit:ITMO University Forskere ved ITMO University har udviklet en ny tilgang til at opnå ikke-toksiske magnetiske fotoniske krystaller, udvide deres applikationer fra fotonik til biomedicin. Nan
- Californiens skovbrand eksploderer, brænder over 25 miles om dagen
- Forskere fremhæver fremskridt inden for biomedicinsk forskning med enzymaktiverede fluorescerende p…
- Lake Erie algeblomstrer frøet internt af overvintrende celler i søbunds sedimenter
- Mudslides, oversvømmelse og lavine advarsler - Hvorfor Californien havde sådan en våd vejr uge
- Forskere demonstrerer biomagnificering af nanomaterialer i en simpel fødekæde
- Coronavirus roder også med vejrudsigten


