Hvordan ioner samler vandmolekyler omkring dem
Når en ion placeres i vand, tiltrækkes den positive ende af vandmolekylet (brintatomerne) af ionens negative ladning, og den negative ende af vandmolekylet (iltatomet) tiltrækkes af den positive ladning af vandmolekylet. ionen. Denne tiltrækning mellem ionen og vandmolekylerne fører til dannelsen af en hydreringsskal, som er et lag af vandmolekyler, der omgiver ionen.
Styrken af hydreringsskallen afhænger af ladningen af ionen og størrelsen af ionen. Ioner med en højere ladning tiltrækker vandmolekyler stærkere end ioner med en lavere ladning. Mindre ioner tiltrækker også vandmolekyler stærkere end større ioner.
Hydratisering af ioner er en vigtig proces i mange biologiske systemer. For eksempel er det essentielt for funktionen af proteiner, som er molekyler, der er opbygget af aminosyrer. Aminosyrer er zwitterioner, hvilket betyder, at de både har en positiv ladning og en negativ ladning. Hydratiseringen af aminosyrerne i proteiner hjælper med at stabilisere proteinstrukturen og tillader den at fungere korrekt.
Ud over sin rolle i biologiske systemer er ionhydrering også vigtig i mange industrielle processer. For eksempel bruges det til vandrensning, galvanisering og produktion af batterier.
 Varme artikler
Varme artikler
-
 Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri
Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri -
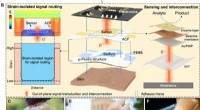 En bærbar, fritstående elektrokemisk sensorsystemFESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet bio
En bærbar, fritstående elektrokemisk sensorsystemFESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet bio -
 In vivo-lægemiddelopdagelse til at øge inkretin-udtrykkende celler i diabetesGrafisk abstrakt. Kredit:Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.08.001 En ny undersøgelse offentliggjort i Cell Chemical Biology beskriver en alternativ tilgang til behandling af
In vivo-lægemiddelopdagelse til at øge inkretin-udtrykkende celler i diabetesGrafisk abstrakt. Kredit:Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.08.001 En ny undersøgelse offentliggjort i Cell Chemical Biology beskriver en alternativ tilgang til behandling af -
 En meget alkalisk stabil Co3O4@Co-MOF-komposit til højtydende elektrokemisk energilagringEt søjlediagram til sammenligning af kapacitansydelse af elektrodematerialer. Kredit:©Science China Press Metal-organiske rammer (MOFer) dannes via selvsamling af metalioner og organiske linkere.
En meget alkalisk stabil Co3O4@Co-MOF-komposit til højtydende elektrokemisk energilagringEt søjlediagram til sammenligning af kapacitansydelse af elektrodematerialer. Kredit:©Science China Press Metal-organiske rammer (MOFer) dannes via selvsamling af metalioner og organiske linkere.
- Hvilke enzymer er ansvarlige for at katalysere produktionen af CO2 i cellulært stofskifte?
- Batterier fremstillet af verdens tyndeste materiale kunne drive morgendagens elbiler
- Et laboratoriums irriterende biprodukt leverer nu 2D materialeforskning
- Koraller lyser vejen til et sundt partnerskab
- Erfaringer fra det sydlige Australiens forretningsopsving midt i skovbrande og pandemi
- Protocellgæster flygter fra reden


