Hvordan viser en korrekt skrevet kemisk ligning, at atomer ikke går tabt i ligningen?
1. Lov om bevarelse af messe:
* Den samlede masse af reaktanterne i en kemisk ligning er lig med den samlede masse af produkterne.
* Det betyder, at antallet af atomer i hvert grundstof skal være det samme på begge sider af ligningen.
2. Balancerede ligninger:
* I en afbalanceret kemisk ligning justeres koefficienterne foran reaktanterne og produkterne for at sikre, at antallet af atomer i hvert grundstof er ens på begge sider.
* Overvej for eksempel forbrænding af metan:
```
CH4 + 2O2 -> CO2 + 2H2O
```
* På reaktantsiden er der et carbonatom, fire hydrogenatomer og fire oxygenatomer. På produktsiden er der også et kulstofatom, fire brintatomer og fire oxygenatomer.
* Dette viser, at antallet af atomer af hvert grundstof er bevaret i reaktionen.
3. Reaktanter og produkter:
* Reaktanterne på venstre side af ligningen repræsenterer udgangsmaterialerne, mens produkterne på højre side repræsenterer stofferne dannet efter reaktionen.
* Ved at afbalancere ligningen sikrer vi, at antallet af atomer i hvert grundstof er det samme på begge sider, hvilket repræsenterer omdannelsen af reaktanter til produkter uden tab eller gevinst af atomer.
4. Koefficienter:
* Koefficienterne i en kemisk ligning angiver de relative mængder af reaktanter og produkter involveret i reaktionen.
* Justering af koefficienterne giver os mulighed for at afbalancere ligningen, hvilket sikrer, at antallet af atomer i hvert grundstof bevares.
* For eksempel i ligningen:
```
2H2 + O2 -> 2H20
```
* Koefficienten 2 foran H2 indikerer, at der kræves to hydrogenmolekyler til reaktionen.
* Dette er vigtigt, fordi det sikrer, at der er nok hydrogenatomer til rådighed til at reagere med det ene oxygenatom i O2, hvilket resulterer i dannelsen af to molekyler H2O.
Ved at overholde reglerne for afbalancering af kemiske ligninger kan vi påvise, at atomer hverken tabes eller vindes under en kemisk reaktion. Dette afspejler det grundlæggende princip om bevarelse af masse, som er en hjørnesten i moderne kemi.
 Varme artikler
Varme artikler
-
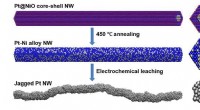 Ru overflader giver yderligere steder for energigenererende reaktioner i brændselscellerFlere aktive steder og mere overfladeareal på katalysatorer fremskynder den kemiske omdannelse af ilt og brint til vand og elektroner, generere elektricitet. Forskere udtænkte en ny synteserute for at
Ru overflader giver yderligere steder for energigenererende reaktioner i brændselscellerFlere aktive steder og mere overfladeareal på katalysatorer fremskynder den kemiske omdannelse af ilt og brint til vand og elektroner, generere elektricitet. Forskere udtænkte en ny synteserute for at -
 Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som
Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som -
 Nyt kunstigt enzym nedbryder sejt, træagtigt lignin:Undersøgelse viser løfte om at udvikle en ny …Woody lignin, set her i renset form, har et betydeligt løfte som et vedvarende biobrændstof, hvis det effektivt kan nedbrydes til nyttig form. Kredit:Andrea Starr | Pacific Northwest National Laborato
Nyt kunstigt enzym nedbryder sejt, træagtigt lignin:Undersøgelse viser løfte om at udvikle en ny …Woody lignin, set her i renset form, har et betydeligt løfte som et vedvarende biobrændstof, hvis det effektivt kan nedbrydes til nyttig form. Kredit:Andrea Starr | Pacific Northwest National Laborato -
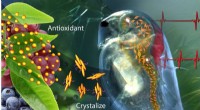 Smart antioxidantholdig polymer reagerer på kroppens kemi, miljøEt nyt lægemiddelleveringssystem, der indeholder krystalliseret catechin - en antioxidant, der findes i grøn te og frugt - kan mærke problemer og reagere ved at frigive antioxidant for at genoprette e
Smart antioxidantholdig polymer reagerer på kroppens kemi, miljøEt nyt lægemiddelleveringssystem, der indeholder krystalliseret catechin - en antioxidant, der findes i grøn te og frugt - kan mærke problemer og reagere ved at frigive antioxidant for at genoprette e
- Brasiliens katastrofale vejr afføder en bølge af konspirationsteorier
- Jernvulkaner kan være gået i udbrud på metalasteroider
- Rekordstore naturbrande i Californien overstiger 4 millioner hektar
- NASA-undersøgelse giver et nyt kig på orbitalaffald, potentielle løsninger
- Skridt mod stuetemperatur superledning
- En ny rummission kan hjælpe fysikere med at besvare behårede spørgsmål om sorte huller


