Hvad er den begrænsende reaktant i Zn 2HCl -- ZnCl2 H2?
Givet den afbalancerede kemiske ligning:
$$Zn + 2HCl -> ZnCl_2 + H_2$$
Lad os antage, at vi har indledende mol af reaktanter a for Zn og b for HCl.
For Zn:
Mol af Zn =a
For HCl:
Mol HCl =b
Ifølge støkiometrien reagerer 1 mol Zn med 2 mol HCl. Så molforholdet er 1:2.
Hvis a <2b, betyder det, at der ikke er nok mol HCl til at reagere fuldstændigt med Zn. I dette tilfælde er HCl den begrænsende reaktant.
Hvis a> 2b betyder det, at der er overskydende mol af Zn, og ikke alt Zn vil blive forbrugt. I dette tilfælde er Zn den begrænsende reaktant.
For at bestemme den begrænsende reaktant uden at kende de faktiske værdier af a og b, kan vi sammenligne molforholdene. Hvis forholdet mellem mol Zn og mol HCl er mindre end 1:2, så er HCl den begrænsende reaktant. Hvis forholdet er større end 1:2, er Zn den begrænsende reaktant.
For at bestemme den begrænsende reaktant i reaktionen Zn + 2HCl -> ZnCl2 + H2 skal vi derfor sammenligne de indledende mol af Zn og HCl og kontrollere, om molforholdet er mindre end eller større end 1:2.
Sidste artikelHvilke metaller har lav massefylde?
Næste artikelEr en brintbinding en sand binding?
 Varme artikler
Varme artikler
-
 Ultrasensitiv giftig detektorEn skematisk illustration af gassensorenheden baseret på hybrid nanorod -arrays. Realtidsmodstanden versus tiden for det lodret justerede WO 3 -CuO core-shell nanorod-arrays-baseret gassensor til va
Ultrasensitiv giftig detektorEn skematisk illustration af gassensorenheden baseret på hybrid nanorod -arrays. Realtidsmodstanden versus tiden for det lodret justerede WO 3 -CuO core-shell nanorod-arrays-baseret gassensor til va -
 Ny undersøgelse af grøn te potentiale til at hjælpe med at tackle COVID-19Kredit:Unsplash/CC0 Public Domain Mens Indien fortsætter med at være hærget af pandemien, en akademiker fra Swansea University undersøger, hvordan grøn te kan give anledning til et lægemiddel, der
Ny undersøgelse af grøn te potentiale til at hjælpe med at tackle COVID-19Kredit:Unsplash/CC0 Public Domain Mens Indien fortsætter med at være hærget af pandemien, en akademiker fra Swansea University undersøger, hvordan grøn te kan give anledning til et lægemiddel, der -
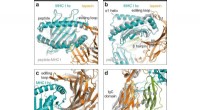 Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db (
Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db ( -
 Flydende krystaller skaber letlæselige, farveskiftende sensorerPME-forskere og ingeniører har udviklet en måde at strække og spænde flydende krystaller på for at generere forskellige farver. Dette kunne anvendes i smarte belægninger, sensorer, og bærbar elektroni
Flydende krystaller skaber letlæselige, farveskiftende sensorerPME-forskere og ingeniører har udviklet en måde at strække og spænde flydende krystaller på for at generere forskellige farver. Dette kunne anvendes i smarte belægninger, sensorer, og bærbar elektroni
- Små dråber åbner dørene til billeddannelse af proteiner under flyvning
- Hvordan man tænker på en opfindelse
- Forskere forklarer, hvordan nanomateriale hjælper antistofrespons
- At vinde på sociale medier er sandsynligvis enklere, end du tror
- Et molekylært kig på begyndende HDL-dannelse
- Verdens migration faldt med 30 procent på grund af pandemi:FN


