Hvor mange gram hydrogengas H2 ville optage 1,55 L ved 607 K og 2,99 ATM?
$$PV =nRT$$
hvor:
* P er trykket i atmosfæren (atm)
* V er volumen i liter (L)
* n er antallet af mol gas
* R er den ideelle gaskonstant (0,08206 L⋅atm/mol⋅K)
* T er temperaturen i Kelvin (K)
Hvis vi omarrangerer den ideelle gaslov til at løse for n, får vi:
$$n =\frac{PV}{RT}$$
Ved at indsætte de givne værdier i ligningen får vi:
$$n =\frac{(2,99 \ atm)(1,55 \ L)}{(0,08206 \ L⋅atm/mol⋅K)(607 \ K)} =0,0798 \ mol$$
For at konvertere mol til gram, skal vi gange antallet af mol med molmassen af brintgas. Den molære masse af brintgas er 2,016 g/mol. Derfor er massen af brintgas, der optager 1,55 L ved 607 K og 2,99 ATM:
$$masse =n × molær \ masse =(0,0798 \ mol)(2,016 \ g/mol) =0,161 \ g$$
Derfor ville 0,161 gram brintgas optage 1,55 L ved 607 K og 2,99 ATM.
 Varme artikler
Varme artikler
-
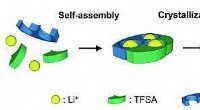 Solide krystaller, der selv samler sig til at danne kanaler for en elektrisk strøm, kunne gøre sik…Når en bestemt organisk forbindelse tilsættes til lithiumsalt, molekylerne samler sig selv for at danne kanaler, hvorigennem litiumioner kan bevæge sig, at skabe en elektrisk strøm. Kredit:Videnskab o
Solide krystaller, der selv samler sig til at danne kanaler for en elektrisk strøm, kunne gøre sik…Når en bestemt organisk forbindelse tilsættes til lithiumsalt, molekylerne samler sig selv for at danne kanaler, hvorigennem litiumioner kan bevæge sig, at skabe en elektrisk strøm. Kredit:Videnskab o -
 Smagsforskning til forbrugerbeskyttelseUdgangspunktet for undersøgelserne var en ren kirsebærjuice lavet af surkirsebær i laboratoriet. Kredit:Gisela Olias / Leibniz-LSB I 2013 den tyske Stiftung Warentest fandt skadelig benzen i drink
Smagsforskning til forbrugerbeskyttelseUdgangspunktet for undersøgelserne var en ren kirsebærjuice lavet af surkirsebær i laboratoriet. Kredit:Gisela Olias / Leibniz-LSB I 2013 den tyske Stiftung Warentest fandt skadelig benzen i drink -
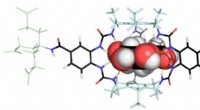 Glucosebindende molekyle kunne transformere behandlingen af diabetesReceptor bindende glucose. Kredit:University of Bristol Forskere fra University of Bristol har designet en ny syntetisk glukosebindende molekyleplatform, der bringer os et skridt tættere på udvikl
Glucosebindende molekyle kunne transformere behandlingen af diabetesReceptor bindende glucose. Kredit:University of Bristol Forskere fra University of Bristol har designet en ny syntetisk glukosebindende molekyleplatform, der bringer os et skridt tættere på udvikl -
 Indestår for Vonnegut:Ingeniører studerer polymer, der fryser ved stuetemperaturNår det blandes med en præcis mængde vand, polymeren størkner til en blød pasta ved stuetemperatur. Kredit:Swanson School of Engineering/Sachin Velankar I Kurt Vonneguts sci-fi-klassiker Kattens
Indestår for Vonnegut:Ingeniører studerer polymer, der fryser ved stuetemperaturNår det blandes med en præcis mængde vand, polymeren størkner til en blød pasta ved stuetemperatur. Kredit:Swanson School of Engineering/Sachin Velankar I Kurt Vonneguts sci-fi-klassiker Kattens
- Udforske, hvad der sker, når forskellige sfæriske objekter rammer vandet
- Gammablazarer på himlen
- Polymersyntese kan hjælpe fremtidens elektronik
- Forbedrende materialer til højopløsningsmønstre for at fremme mikroelektronikken
- Tysklands Bosch tænder brintceller til biler
- Fra en hjernescanning, mere information til medicinsk kunstig intelligens


