Forklar hvordan valenselektroner i et atom bruges til at danne et fuldt yderste energiniveau?
1. Stabil elektronkonfiguration :Atomer har en tendens til at opnå en stabil elektronkonfiguration, som typisk er elektronkonfigurationen af en ædelgas. Ædelgasser har et fuldt yderste energiniveau, hvilket gør dem kemisk inerte.
2. Elektrondeling og -binding :Atomer kan opnå et fuldt yderste energiniveau ved at dele valenselektroner med andre atomer gennem kemisk binding. Denne proces gør det muligt for atomer at vinde, miste eller dele elektroner for at opnå en stabil konfiguration.
3. Ionisk binding :Ved ionbinding overføres en eller flere valenselektroner fra et atom til et andet. Atomet, der taber elektroner, bliver positivt ladet (kation), mens det atom, der får elektroner, bliver negativt ladet (anion). Den elektrostatiske tiltrækning mellem modsat ladede ioner holder den ioniske forbindelse sammen.
4. Kovalent binding :Ved kovalent binding deler atomer valenselektroner uden at overføre dem fuldstændigt. Denne deling af elektroner resulterer i dannelsen af en kovalent binding, som er en stærk kemisk binding. Kovalente bindinger dannes, når atomer har lignende elektronegativiteter, hvilket betyder, at de har en lignende tiltrækning for elektroner.
5. Metalisk binding :Ved metallisk binding er valenselektroner delokaliserede og er ikke forbundet med noget bestemt atom. Disse mobile valenselektroner danner et "hav" af elektroner, der flyder gennem metalgitteret. Dette hav af elektroner er ansvarlig for metallers karakteristiske egenskaber, såsom høj elektrisk og termisk ledningsevne, glans og formbarhed.
6. Oktetregel :Oktetreglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå et fuldt yderste energiniveau, normalt med otte elektroner (undtagen brint og helium, som opnår et fuldt yderste energiniveau med to elektroner). Denne regel er især vigtig for at forstå kovalent binding.
7. Undtagelser :Der er nogle undtagelser fra oktetreglen, især for atomer i tredje række (og derefter) i det periodiske system. Disse atomer kan nogle gange rumme mere end otte valenselektroner i deres yderste energiniveau.
Ved at bruge deres valenselektroner kan atomer opnå en stabil elektronkonfiguration og danne kemiske bindinger med andre atomer, hvilket fører til dannelsen af molekyler og forbindelser med forskellige strukturer og egenskaber. At forstå opførselen af valenselektroner er afgørende for at forstå grundstoffernes kemiske binding og reaktivitet.
Sidste artikelSæt følgende bindinger i rækkefølge h-br h-du h-h h-f h-cl?
Næste artikelEr P4S7 og ionisk af molekylær forbindelse?
 Varme artikler
Varme artikler
-
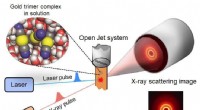 Hvert øjeblik med ultrahurtig kemisk binding fanget på filmBindingsdannelsesreaktionen i et guldtrimerkompleks initieres af en laserpuls, og en tredimensionel struktur efter en bestemt tidsforsinkelse detekteres af et røntgenstrålingsbillede. Kredit:IBS M
Hvert øjeblik med ultrahurtig kemisk binding fanget på filmBindingsdannelsesreaktionen i et guldtrimerkompleks initieres af en laserpuls, og en tredimensionel struktur efter en bestemt tidsforsinkelse detekteres af et røntgenstrålingsbillede. Kredit:IBS M -
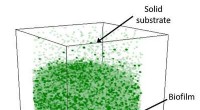 Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm
Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm -
 Genbrugsbeton kan være en bæredygtig måde at holde murbrokkerne væk fra lossepladserShahria Alam, meddirektør for UBCs Green Construction Research and Training Center og den ledende efterforsker af undersøgelsen. Kredit:UBC Okanagan Resultaterne af en ny fem-årig undersøgelse af
Genbrugsbeton kan være en bæredygtig måde at holde murbrokkerne væk fra lossepladserShahria Alam, meddirektør for UBCs Green Construction Research and Training Center og den ledende efterforsker af undersøgelsen. Kredit:UBC Okanagan Resultaterne af en ny fem-årig undersøgelse af -
 Beregningsstrategier overvinder hindringer i udviklingen af peptidterapiEn kunstners opfattelse af kraften ved beregningsmæssigt design til at udforske og belyse strukturerede peptider på tværs af det enorme energilandskab. Kredit:Vikram Mulligan/University of Washington
Beregningsstrategier overvinder hindringer i udviklingen af peptidterapiEn kunstners opfattelse af kraften ved beregningsmæssigt design til at udforske og belyse strukturerede peptider på tværs af det enorme energilandskab. Kredit:Vikram Mulligan/University of Washington
- Vær 1 skridt foran:Forskning viser, hvordan bakterier holder sig foran vacciner og antibiotika
- Livet og døden af et af Amerikas mest mystiske træer
- Automatiseret maskinlæringsrobot åbner op for nyt potentiale for genetisk forskning
- En hemmelighed for, hvordan TB hænger ved dig
- Hvordan tidevandet tændte datacentre i Europa
- Sådan tegnes en oktagon eller 8-sidet Polygon


