Hvorfor er mgcl2 bedre koagulerende end kcl for As2S3?
1. Opladningstæthed: MgCl2 dissocierer i vand og danner Mg2+ og 2Cl- ioner. Mg2+-ionen har en højere ladningstæthed end K+-ionen. Dette betyder, at Mg2+-ioner kan interagere stærkere med den negativt ladede overflade af As2S3-partikler, hvilket fører til bedre koagulering.
2. Ionisk styrke: En opløsnings ionstyrke er et mål for koncentrationen af ioner i opløsningen. MgCl2 har en højere ionstyrke end KCl. Dette betyder, at MgCl2 kan reducere den elektrostatiske frastødning mellem As2S3-partikler, så de kan komme tættere på hinanden og koagulere.
3. Opløselighed: MgCl2 er mere opløseligt i vand end KCl. Det betyder, at MgCl2 kan anvendes i højere koncentrationer uden risiko for udfældning. Højere koncentrationer af MgCl2 kan føre til mere effektiv koagulering af As2S3.
4. Hydrolyse: MgCl2 undergår hydrolyse i vand og producerer H+ og OH-ioner. H+-ionerne kan reagere med overfladen af As2S3-partikler og danne uopløselige metalhydroxider, der slår partiklerne sammen og fremmer koagulering.
Sammenfattende gør den højere ladningsdensitet, ionstyrke, opløselighed og evne til at gennemgå hydrolyse MgCl2 til et bedre koaguleringsmiddel for As2S3 sammenlignet med KCl.
 Varme artikler
Varme artikler
-
 En legering, der bevarer sin hukommelse ved høje temperaturerAlexander Paulsen (th.) og Alberto Ferrari har bragt teori og praksis sammen. Kredit:RUB, Marquard Ved hjælp af computersimulering, Alberto Ferrari beregnede et designforslag til en formhukommelse
En legering, der bevarer sin hukommelse ved høje temperaturerAlexander Paulsen (th.) og Alberto Ferrari har bragt teori og praksis sammen. Kredit:RUB, Marquard Ved hjælp af computersimulering, Alberto Ferrari beregnede et designforslag til en formhukommelse -
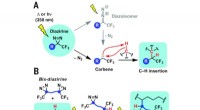 En ny form for lim til at binde polyethylenEn bis-diazirin-strategi til polymertværbinding. (A) Mekanisme for carbendannelse fra lys- eller varmefremkaldt nedbrydning af diaziriner, efterfulgt af C – H indsættelse. hν, ultraviolet lys. (B) Tvæ
En ny form for lim til at binde polyethylenEn bis-diazirin-strategi til polymertværbinding. (A) Mekanisme for carbendannelse fra lys- eller varmefremkaldt nedbrydning af diaziriner, efterfulgt af C – H indsættelse. hν, ultraviolet lys. (B) Tvæ -
 Bioinspirerede molekylære farvestoffer til biomedicinsk fluorescerende billeddannelseLong Stokes skifter SOD til biomedicinsk fluorescensbilleddannelse. (A) Kemisk struktur, molekylvægt, maksimal absorption og emissionsbølgelængde, Stokes skift af typiske kommercielle fluorescerende f
Bioinspirerede molekylære farvestoffer til biomedicinsk fluorescerende billeddannelseLong Stokes skifter SOD til biomedicinsk fluorescensbilleddannelse. (A) Kemisk struktur, molekylvægt, maksimal absorption og emissionsbølgelængde, Stokes skift af typiske kommercielle fluorescerende f -
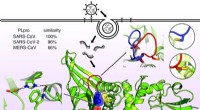 Information om molekylær form af vira, der forårsager COVID-19, SARS, og MERS afslører strukturel…Molekylær struktur af det papainlignende enzym kendt som PLPro. Dette enzym tillader de vira, der forårsager SARS, MERS, og COVID-19 for at inficere celler og replikere og undertrykke værtens immunfun
Information om molekylær form af vira, der forårsager COVID-19, SARS, og MERS afslører strukturel…Molekylær struktur af det papainlignende enzym kendt som PLPro. Dette enzym tillader de vira, der forårsager SARS, MERS, og COVID-19 for at inficere celler og replikere og undertrykke værtens immunfun
- CES 2019:Kinesiske teknologivirksomheder ligger lavere midt i handelsspændinger
- Et frisk pust til længerevarende batterier
- Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtid
- Forskerhold studerer binære filer for at skabe hoveder eller haler af planetdannelse
- FAA vildledte Kongressen om Boeing MAX-inspektøruddannelse:rapport
- Nyopdaget supernova kan omskrive teorier om eksploderende stjerneoprindelse


