En chromoxidforbindelse indeholder 104,0 g og 48,0 ilt. hvad er den mest sandsynlige empiriske formel denne forbindelse?
Givet:
- Masse af krom =104,0 g
- Masse ilt =48,0 g
- Molær masse af chrom =51,996 g/mol
- Molær masse af oxygen =15,999 g/mol
Lad os beregne mol af krom og oxygen i forbindelsen:
- Mol chrom =104,0 g / 51,996 g/mol =2,00 mol
- Mol oxygen =48,0 g / 15,999 g/mol =3,00 mol
For at finde det enkleste hele talforhold mellem krom og oxygen dividerer vi begge mol med det mindste antal mol:
- Mol chrom (forenklet) =2,00 mol / 2,00 mol =1
- Mol ilt (forenklet) =3,00 mol / 2,00 mol =1,5
Da vi ikke kan have halve mol i en kemisk formel, multiplicerer vi begge forenklede mol med 2 for at få hele tal:
- Mol chrom (endelig) =1 * 2 =2
- Mol ilt (endelig) =1,5 * 2 =3
Derfor er den mest sandsynlige empiriske formel for denne forbindelse Cr2O3 .
 Varme artikler
Varme artikler
-
 Hår finder nye rødder som vækstmedium for urban farmingGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c01668 Klumperne af kasseret hår på salongulvet kan en dag hjælpe med at dyrke din frokostsalat, t
Hår finder nye rødder som vækstmedium for urban farmingGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c01668 Klumperne af kasseret hår på salongulvet kan en dag hjælpe med at dyrke din frokostsalat, t -
 Forskere finder nye sukkererstatninger i citrus, der kan ændre fødevare- og drikkevareindustrienKredit:Pixabay/CC0 Public Domain Amerikanernes kærlighedsforhold til sukker kan være en dødelig attraktion, der nogle gange fører til store helbredsproblemer, herunder fedme og type 2-diabetes. At
Forskere finder nye sukkererstatninger i citrus, der kan ændre fødevare- og drikkevareindustrienKredit:Pixabay/CC0 Public Domain Amerikanernes kærlighedsforhold til sukker kan være en dødelig attraktion, der nogle gange fører til store helbredsproblemer, herunder fedme og type 2-diabetes. At -
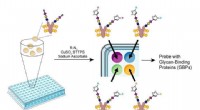 Ny TSRI-metode fremskynder undersøgelser af kulhydratbiologiEn ny metode til at samle et glycan-array. Kredit:Wu Lab / Scripps Research Institute 28. februar, 2018 - Næsten alle levende celler er besat med forgrenede kulhydratkæder kaldet glykaner. Glykane
Ny TSRI-metode fremskynder undersøgelser af kulhydratbiologiEn ny metode til at samle et glycan-array. Kredit:Wu Lab / Scripps Research Institute 28. februar, 2018 - Næsten alle levende celler er besat med forgrenede kulhydratkæder kaldet glykaner. Glykane -
 Rød, hvid men sjældent blå - videnskaben om fyrværkerifarver, forklaretFyrværkeri er en klasse af eksplosive pyrotekniske enheder, der normalt findes i omkring syv farver. Kredit:Shahril KHMD/Shutterstock.com I de tidligste dage af USA, John Adams skrev til sin kone
Rød, hvid men sjældent blå - videnskaben om fyrværkerifarver, forklaretFyrværkeri er en klasse af eksplosive pyrotekniske enheder, der normalt findes i omkring syv farver. Kredit:Shahril KHMD/Shutterstock.com I de tidligste dage af USA, John Adams skrev til sin kone
- Hvordan fremstilles glycerol?
- Udforskning af det kinesiske rumstationsprojekt
- Forskere opdager nyt magnetisk fænomen med industrielt potentiale
- Fødselstal, ægteskab, kønsroller vil ændre sig dramatisk i den post-pandemiske verden, videnskab…
- Højt ladede molekyler opfører sig paradoksalt
- Kemikere skaber 3D-printet grafenskum


