Hvad sker der, når natrium behandles med ammoniak?
1. Danning af natrium-ammoniakkompleks :Når natrium kommer i kontakt med vandfri ammoniak, danner det i begyndelsen et natrium-ammoniakkompleks. Dette kompleks involverer solvatisering af natriumioner (Na+) af ammoniakmolekyler (NH3). Ammoniakmolekylerne omgiver natriumionerne, hvilket skaber en solvatiseret art, der kan reagere yderligere.
2. Elektronoverførsel og hydrogenudvikling :Reaktionen mellem natrium og ammoniak er en redoxreaktion, hvor natrium virker som et reduktionsmiddel, og ammoniak virker som et oxidationsmiddel. Under reaktionen overfører de meget elektropositive natriumatomer elektroner til ammoniakmolekyler. Denne overførsel fører til reduktion af ammoniak, hvilket resulterer i dannelse af brintgas (H2) og amidioner (NH2-).
Den samlede reaktion kan repræsenteres som følger:
2Na + 2NH3 → 2NaNH2 + H2
3. Natriumamiddannelse :Amidionerne (NH2-) dannet i reaktionen kombineres med natriumioner (Na+) for at producere natriumamid (NaNH2). Natriumamid er en farveløs, krystallinsk forbindelse, der er opløselig i ammoniak og visse organiske opløsningsmidler. Det er et alsidigt reagens, der er meget udbredt i organisk syntese og industrielle processer.
4. Udvikling af brintgas :Som et biprodukt af reaktionen udvikles brintgas (H2). Den producerede brintgas kan opsamles og bruges i forskellige applikationer, såsom brændselsceller, hydrogeneringsprocesser og som et reduktionsmiddel i visse kemiske reaktioner.
Det er vigtigt at bemærke, at denne reaktion skal udføres under kontrollerede forhold, typisk i laboratoriemiljøer, ved brug af passende sikkerhedsforanstaltninger og håndteringsteknikker. Natrium kan reagere kraftigt med vand, så brugen af vandfri ammoniak er afgørende for at undgå uønskede reaktioner eller farer.
Sidste artikelHvordan udfylder man molekylær ligning for hcl og caco3?
Næste artikelHvad er forskellen mellem rent og blandet stof?
 Varme artikler
Varme artikler
-
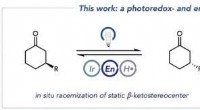 Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra
Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra -
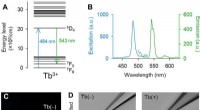 Terbium (III)-doteret fluorescerende glas til biomedicinsk forskningTb3+-doterede pipetter udsender grøn fluorescens. (A) Partielt energiniveaudiagram af Tb3+ [ekstraheret delvist fra (14)]. (B) Excitation (blå) og emission (grøn) spektre af 3,1 mol % Tb3+-doteret gla
Terbium (III)-doteret fluorescerende glas til biomedicinsk forskningTb3+-doterede pipetter udsender grøn fluorescens. (A) Partielt energiniveaudiagram af Tb3+ [ekstraheret delvist fra (14)]. (B) Excitation (blå) og emission (grøn) spektre af 3,1 mol % Tb3+-doteret gla -
 Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø -
 Intelligent genvinding og genbrug af balsatræOmkring 20 procent af elektriciteten i Tyskland blev produceret af vindmøller i 2018. Kredit:Hans-Peter Merten/MATOfoto Der er 30, 000 vindmøller i drift i Tyskland, hvoraf mange begynder at ældes
Intelligent genvinding og genbrug af balsatræOmkring 20 procent af elektriciteten i Tyskland blev produceret af vindmøller i 2018. Kredit:Hans-Peter Merten/MATOfoto Der er 30, 000 vindmøller i drift i Tyskland, hvoraf mange begynder at ældes
- Brugen af elektriske ledere og isolatorer
- Ny bioink bringer 3D-print af menneskelige organer tættere på virkeligheden
- Er Webb ved sin endelige temperatur?
- Undersøgelse viser, at australiere er rigere end nogensinde, men bekymrende tegn for nogle
- Er platinon en del af platinfamilien?
- Jordskred, oversvømmelser, mens monsunen rammer det sydlige Myanmar


