Hvad er pH-værdien af triethylammoniumacetatbuffer?
pH =pKa + log([A-]/[HA])
hvor:
pH er bufferens pH
pKa er syredissociationskonstanten for den svage syre
[A-] er koncentrationen af den konjugatbase
[HA] er koncentrationen af den svage syre
I tilfælde af triethylammoniumacetatbuffer er den svage syre eddikesyre (CH3COOH), og konjugatbasen er triethylammoniumacetat (CH3COO-NEt3). pKa af eddikesyre er 4,76.
Lad os sige, at vi har en triethylammoniumacetatbuffer med en koncentration på 0,1 M eddikesyre og 0,1 M triethylammoniumacetat. Ved at sætte disse værdier ind i Henderson-Hasselbalch-ligningen får vi:
pH =4,76 + log(0,1/0,1)
pH =4,76 + 0
pH =4,76
Derfor er pH-værdien af triethylammoniumacetatbufferen 4,76.
Sidste artikelListe og definere erstatning i kemi?
Næste artikelHvilke materialer er let tilgængelige til at udføre eksperimenter på?
 Varme artikler
Varme artikler
-
 Ny tilgang vil hjælpe med at identificere lægemidler, der kan lime proteiner sammenKredit:Pixabay/CC0 Public Domain En ny screeningsmetode, der kan teste effektiviteten af terapeutiske molekyler designet til at lime proteiner sammen i kroppen, er udviklet af forskere ved Unive
Ny tilgang vil hjælpe med at identificere lægemidler, der kan lime proteiner sammenKredit:Pixabay/CC0 Public Domain En ny screeningsmetode, der kan teste effektiviteten af terapeutiske molekyler designet til at lime proteiner sammen i kroppen, er udviklet af forskere ved Unive -
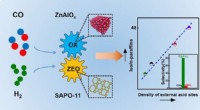 Direkte syntese af isoparaffinrig benzin fra syngasDirekte syngaskonvertering til isoparaffinrig benzin over OXZEO-katalysator. Kredit:Feng Jingyao Et forskerhold ledet af prof. Pan Xiulian og prof. Bao Xinhe fra Dalian Institute of Chemical Physic
Direkte syntese af isoparaffinrig benzin fra syngasDirekte syngaskonvertering til isoparaffinrig benzin over OXZEO-katalysator. Kredit:Feng Jingyao Et forskerhold ledet af prof. Pan Xiulian og prof. Bao Xinhe fra Dalian Institute of Chemical Physic -
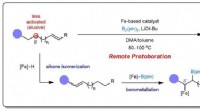 Bæredygtig jernkatalyse muliggør kontrollerbar alkenboryleringFigur 1:Skematisk viser designet af fjernprotoborering for at opnå selektiv borylering ved mindre aktiverede β-positioner. Kredit:National University of Singapore Kemikere fra National University
Bæredygtig jernkatalyse muliggør kontrollerbar alkenboryleringFigur 1:Skematisk viser designet af fjernprotoborering for at opnå selektiv borylering ved mindre aktiverede β-positioner. Kredit:National University of Singapore Kemikere fra National University -
 Maskinlæring tilbyder en ny måde at designe kirale krystaller påFor at bygge en chiral magnet (billedet), det er nødvendigt først at designe en chiral krystal. Kredit:Julien Zaccaro / Center for Chiral Science Ingeniører og kemikere ved Hiroshima University ha
Maskinlæring tilbyder en ny måde at designe kirale krystaller påFor at bygge en chiral magnet (billedet), det er nødvendigt først at designe en chiral krystal. Kredit:Julien Zaccaro / Center for Chiral Science Ingeniører og kemikere ved Hiroshima University ha
- Indonesien Go-Jek går ind på markedet i Singapore, udfordringer Grab
- Forskning tyder på mod slutningen af istiden, mennesker var vidne til brande større end dinosaur…
- Desktop-udskrivning på nano-niveau
- Dusinvis af nye dyrelivskorridorer identificeret for afrikanske pattedyr
- Franske luksusgiganter dykker ned i Silicon Valley
- Hjernedød, hvordan virker


