Er deling af elektroner i polære kovalente bindinger ens?
I en polær kovalent binding vil atomet med den større elektronegativitet tiltrække elektronerne stærkere. Dette vil skabe en delvis positiv ladning på atomet med den lavere elektronegativitet og en delvis negativ ladning på atomet med den højere elektronegativitet.
Forskellen i elektronegativitet mellem de to atomer bestemmer bindingens polaritet. Jo større forskellen i elektronegativitet er, jo mere polær vil bindingen være.
Polære kovalente bindinger findes i mange molekyler, herunder vand, ammoniak og kuldioxid. Polariteten af disse bindinger er vigtig for at forstå molekylernes egenskaber. For eksempel er polariteten af vandmolekyler ansvarlig for dens høje overfladespænding og dens evne til at opløse mange stoffer.
 Varme artikler
Varme artikler
-
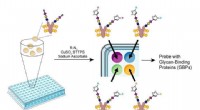 Ny TSRI-metode fremskynder undersøgelser af kulhydratbiologiEn ny metode til at samle et glycan-array. Kredit:Wu Lab / Scripps Research Institute 28. februar, 2018 - Næsten alle levende celler er besat med forgrenede kulhydratkæder kaldet glykaner. Glykane
Ny TSRI-metode fremskynder undersøgelser af kulhydratbiologiEn ny metode til at samle et glycan-array. Kredit:Wu Lab / Scripps Research Institute 28. februar, 2018 - Næsten alle levende celler er besat med forgrenede kulhydratkæder kaldet glykaner. Glykane -
 Undersøgelse detaljerede regulering af en multi-drug transporter(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vande
Undersøgelse detaljerede regulering af en multi-drug transporter(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vande -
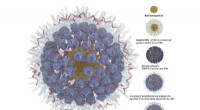 Kunne guld være nøglen til at lave genterapi for HIV, blodsygdomme mere tilgængelige?Grafik af en fuldt ladet guld nanopartikel med CRISPR og andre genredigeringsværktøjer. Kredit:Adair-laboratoriet hos Fred Hutch. Forskere ved Fred Hutchinson Cancer Research Center tog et skridt
Kunne guld være nøglen til at lave genterapi for HIV, blodsygdomme mere tilgængelige?Grafik af en fuldt ladet guld nanopartikel med CRISPR og andre genredigeringsværktøjer. Kredit:Adair-laboratoriet hos Fred Hutch. Forskere ved Fred Hutchinson Cancer Research Center tog et skridt -
 Flydende kernefibre:En dataflod løber gennem demKernen i den kilometerlange optiske fiber består af glycerin overalt. Kredit:Empa Data og signaler kan overføres hurtigt og pålideligt med glasfibre - så længe fiberen ikke går i stykker. Kraftig
Flydende kernefibre:En dataflod løber gennem demKernen i den kilometerlange optiske fiber består af glycerin overalt. Kredit:Empa Data og signaler kan overføres hurtigt og pålideligt med glasfibre - så længe fiberen ikke går i stykker. Kraftig
- LIGO -opdagelsen blev kåret til Sciences 2016 Årets gennembrud
- Opvarmning i Midtvesten kan resultere i majs, sojaproduktionen flytter nordpå
- Landbrugsplukkere i USA vil se usikre varme arbejdsdage fordobles inden 2050
- Gammel katastrofal tørke fører til spørgsmålet:Hvor alvorlige kan klimaændringer blive?
- En elev bruger en kraft på 45 Newton til at skubbe stolen ved konstant hastighed 3m/s i tid 6 sekun…
- Hvordan redningen af ozonlaget i 1987 bremsede den globale opvarmning


