Hvorfor er ionproduktkonstanten af vand temperaturafhængig?
Kw =[H+][OH-] =1,86 x 10^-16 ved 25 °C
Hvor Kw er ionproduktkonstanten for vand, [H+] er koncentrationen af hydrogenioner, og [OH-] er koncentrationen af hydroxidioner.
Ved højere temperaturer stiger Kw, hvilket betyder, at koncentrationen af H+ og OH- ioner i vand stiger. Det skyldes, at jo højere temperatur, jo mere energi har vandmolekylerne, og jo større sandsynlighed er der for, at de går fra hinanden i H+ og OH- ioner.
Omvendt falder Kw ved lavere temperaturer, hvilket betyder, at koncentrationen af H+ og OH- ioner i vand falder. Det skyldes, at jo lavere temperatur, jo mindre energi har vandmolekylerne, og jo mindre sandsynlighed er der for, at de går fra hinanden i H+ og OH- ioner.
Temperaturafhængigheden af Kw har vigtige konsekvenser for mange kemiske og biologiske processer, der forekommer i vand. For eksempel bestemmes vands pH af koncentrationen af H+ ioner, og da Kw er temperaturafhængig, er pH også det. Dette kan have en væsentlig indflydelse på adfærden af enzymer og andre proteiner, der er følsomme over for pH-ændringer.
Sammenfattende er ionproduktkonstanten for vand temperaturafhængig, fordi ligevægtskoncentrationen af H+ og OH- ioner i vand ændres med temperaturen. Dette har vigtige implikationer for mange kemiske og biologiske processer, der forekommer i vand, herunder vands pH og opførsel af enzymer og andre proteiner.
 Varme artikler
Varme artikler
-
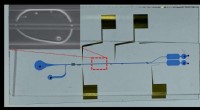 Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top
Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top -
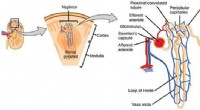 Enhed til at fremskynde opdagelse af lægemidler til nyresygdommeKredit:CNX OpenStax Forskere fra Institut for Ingeniørvidenskab samarbejder med industrien og den akademiske verden om at udvikle et apparat til at forbedre testningen af lægemidler til nyresygd
Enhed til at fremskynde opdagelse af lægemidler til nyresygdommeKredit:CNX OpenStax Forskere fra Institut for Ingeniørvidenskab samarbejder med industrien og den akademiske verden om at udvikle et apparat til at forbedre testningen af lægemidler til nyresygd -
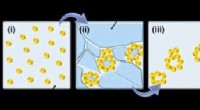 Multi-skala strukturerede materialer til elektrokatalyse og fotoelektrokatalyseSkematisk præsentation af fryse-tø-metoden. Kredit:Wiley-VCH Som en ny klasse af porøse materialer, noble metal aerogels (NMAer) har tiltrukket opmærksomhed for deres selvbærende arkitekturer, høj
Multi-skala strukturerede materialer til elektrokatalyse og fotoelektrokatalyseSkematisk præsentation af fryse-tø-metoden. Kredit:Wiley-VCH Som en ny klasse af porøse materialer, noble metal aerogels (NMAer) har tiltrukket opmærksomhed for deres selvbærende arkitekturer, høj -
 Måling af eliminering af plastikpartikler fra kroppen hos musFigur 1. PET-CT billeder af mus ved 6, 12, 24, og 48 timer efter oral administration af 20 nm polystyrenpartikler (øverste række) og 1 µm polystyrenpartikler (nederste række). Grøn kant:MIP, blå kant:
Måling af eliminering af plastikpartikler fra kroppen hos musFigur 1. PET-CT billeder af mus ved 6, 12, 24, og 48 timer efter oral administration af 20 nm polystyrenpartikler (øverste række) og 1 µm polystyrenpartikler (nederste række). Grøn kant:MIP, blå kant:


