Et stofs smeltepunkt er den temperatur, hvorved det skifter fra fast til flydende tilstand. Generelt har stoffer med stærke intermolekylære kræfter højere smeltepunkter end stoffer med svage intermolekylære kræfter. Ioniske forbindelser er faste stoffer sammensat af positive og negative ioner, der holdes sammen af stærke elektrostatiske tiltrækningskræfter. Disse elektrostatiske kræfter mellem ionerne bliver stærkere, efterhånden som ladningerne på ionerne øges, og når ionernes størrelse aftager. Derfor har faste ioniske forbindelser generelt høje smeltepunkter på grund af de stærke elektrostatiske kræfter, der holder ionerne på plads. Styrken af ionbindingerne afhænger af ladningen af ionerne og afstanden mellem dem. Ioner med højere ladninger og mindre radier har stærkere elektrostatiske tiltrækninger og danner derfor ioniske forbindelser med højere smeltepunkter. Eksempelvis smelter natriumchlorid (NaCl), en ionforbindelse med et relativt lavt smeltepunkt, ved 801 °C og består af natriumioner (Na+) og chloridioner (Cl-). I modsætning hertil smelter magnesiumoxid (MgO), en ionisk forbindelse med et højt smeltepunkt, ved 2800 °C og indeholder magnesiumioner (Mg2+) og oxidioner (O2-). Det højere smeltepunkt for magnesiumoxid skyldes de højere ladninger på både magnesium- og oxygenioner.
 Varme artikler
Varme artikler
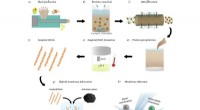 Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru
Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru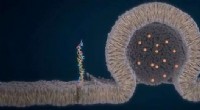 Sådan dannes en kanal mellem to organellerKreditering:Je-Kyung Ryu Kanalen, gennem hvilken to cellekomponenter udveksler materiale, ser ud til at dannes ved kanten af deres kontaktflade, og ikke i midten. Dette blev opdaget af de Leiden
Sådan dannes en kanal mellem to organellerKreditering:Je-Kyung Ryu Kanalen, gennem hvilken to cellekomponenter udveksler materiale, ser ud til at dannes ved kanten af deres kontaktflade, og ikke i midten. Dette blev opdaget af de Leiden Selvbærende sløjfe af kemiske reaktioner kan revolutionere lægemiddelproduktionenEksperter fra University of Nottingham har skabt et selvbærende kredsløb af reaktioner, som er en grønnere og mere effektiv metode til kemisk produktion. offentliggjort i Nature Catalysis, Drs. France
Selvbærende sløjfe af kemiske reaktioner kan revolutionere lægemiddelproduktionenEksperter fra University of Nottingham har skabt et selvbærende kredsløb af reaktioner, som er en grønnere og mere effektiv metode til kemisk produktion. offentliggjort i Nature Catalysis, Drs. France Gør hundefoder mere lækker ved at analysere aromaerKredit:CC0 Public Domain Hunde er ikke kendt for at være kræsne omkring deres mad, spiser den samme kibble dag efter dag med nydelse. Imidlertid, ejere af forkælede pooches vil have, at deres kæle
Gør hundefoder mere lækker ved at analysere aromaerKredit:CC0 Public Domain Hunde er ikke kendt for at være kræsne omkring deres mad, spiser den samme kibble dag efter dag med nydelse. Imidlertid, ejere af forkælede pooches vil have, at deres kæle

