Hvilke volumener på 0,200 m hcooh og 2,00 naoh ville gøre 500 ml til en buffer med samme pH som en lavet af 475 benzoesyre 25 naoh?
$$pH =pK_a + log \frac{[A^-]}{[HA]}$$
hvor:
* pH er opløsningens surhedsgrad
* pKa er syredissociationskonstanten for den svage syre
* [A-] er koncentrationen af den konjugerede base af den svage syre
* [HA] er koncentrationen af den svage syre
Vi kan bruge Henderson-Hasselbalch-ligningen til at beregne pH-værdien af en bufferopløsning. Vi kender pH-værdien af den bufferopløsning, vi ønsker at lave (4,75) og pKa af benzoesyre (4,20). Vi kan også antage, at koncentrationen af den konjugerede base af benzoesyre er lig med koncentrationen af natriumbenzoat. Derfor kan vi omarrangere Henderson-Hasselbalch-ligningen for at løse koncentrationen af benzoesyre:
$$[HA] =\frac{[A^-]}{10^{pH - pK_a}}$$
Ved at erstatte de værdier, vi kender i ligningen, får vi:
$$[HA] =\frac{0,025}{10^{4,75 - 4,20}} =0,0040 M$$
Den totale koncentration af benzoesyre og natriumbenzoat i bufferopløsningen er 0,029 M. Derfor er volumenet af 0,200 M benzoesyre, vi skal tilføje for at lave 500 ml af bufferopløsningen:
$$V_{BA} =\frac{(0,0040 M)(500 mL)}{0,200 M} =10,0 mL$$
Volumenet af 2,00 M natriumhydroxid, vi skal tilføje for at lave 500 ml af bufferopløsningen, er:
$$V_{NaOH} =\frac{(0,025 M)(500 mL)}{2,00 M} =6,25 mL$$
Derfor skal vi tilføje 10,0 mL 0,200 M benzoesyre og 6,25 mL 2,00 M natriumhydroxid for at lave 500 mL af en bufferopløsning med samme pH som en fremstillet af 475 benzoesyre 25 naoh.
Sidste artikelHvad er syrefældningen et middel for?
Næste artikelHvor fandt du kulstof?
 Varme artikler
Varme artikler
-
 Nøglen til forbedret grøn teknologieffektivitet fundet i simpel syrebehandlingForynget overflade forbedrer iltelektrode-elektrolytgrænsefladestyrken. Kredit:Nature (2022). DOI:10.1038/s41586-022-04457-y Udviklingen af nye, mere effektive elektrokemiske celler kunne være en
Nøglen til forbedret grøn teknologieffektivitet fundet i simpel syrebehandlingForynget overflade forbedrer iltelektrode-elektrolytgrænsefladestyrken. Kredit:Nature (2022). DOI:10.1038/s41586-022-04457-y Udviklingen af nye, mere effektive elektrokemiske celler kunne være en -
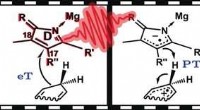 Trinvis hydridoverførsel i biosyntesen af klorofylHydridoverførsel er en vigtig reaktion for kemi (f.eks. brændstofceller), samt biologi (f.eks. respirationskæde og fotosyntese). Tit, en delreaktion involverer overførsel af en hydridion (H−). Men inv
Trinvis hydridoverførsel i biosyntesen af klorofylHydridoverførsel er en vigtig reaktion for kemi (f.eks. brændstofceller), samt biologi (f.eks. respirationskæde og fotosyntese). Tit, en delreaktion involverer overførsel af en hydridion (H−). Men inv -
 Hvordan bakterier kan genvinde ædle metaller fra batterier til elbilerKredit:Paul Craft/Shutterstock Der er mere end 1,4 milliarder biler i verden i dag, og det tal kan fordobles inden 2036. Hvis alle de biler brænder benzin eller diesel, klimakonsekvenserne vil vær
Hvordan bakterier kan genvinde ædle metaller fra batterier til elbilerKredit:Paul Craft/Shutterstock Der er mere end 1,4 milliarder biler i verden i dag, og det tal kan fordobles inden 2036. Hvis alle de biler brænder benzin eller diesel, klimakonsekvenserne vil vær -
 Værktøjssæt:Brug af lokal jord til 3D-print af store strukturer(A) Illustration af geopolymerisationstilgang udviklet til at størkne moskus til en bærende silikatkomposit, som repræsenteret ved kraften af et bildæk på vej forstærket af kompositmaterialet, genop
Værktøjssæt:Brug af lokal jord til 3D-print af store strukturer(A) Illustration af geopolymerisationstilgang udviklet til at størkne moskus til en bærende silikatkomposit, som repræsenteret ved kraften af et bildæk på vej forstærket af kompositmaterialet, genop
- Video:Optagelser viser, hvordan droner kan øge bevaring af skildpadder
- Eksperter opfordrer til et nationalt rådgivende udvalg for forskningsintegritet
- Hjerteceller reagerer på stive omgivelser
- Jupiters Core vs Earths Core
- Fattige menneskers villighed til at stemme påvirkes af lokalsamfundet
- Fem grunde til, at eksperter tror, at autonome biler er mange år væk


