Hvad er forskellen mellem ethan og ethylen?
1. Struktur
Den største forskel mellem ethan og ethylen er i deres molekylære struktur. Ethan er et mættet kulbrinte, hvilket betyder, at alle dets kulstofatomer er bundet til fire andre atomer. Ethylen er på den anden side et umættet kulbrinte, hvilket betyder, at det har mindst én dobbeltbinding mellem to kulstofatomer.
2. Fysiske egenskaber
Som et resultat af deres forskellige strukturer har ethan og ethylen forskellige fysiske egenskaber. Ethan er en gas ved stuetemperatur, mens ethylen er en gas ved stuetemperatur. Ethan er også mindre tæt end ethylen.
3. Kemiske egenskaber
Ethan og ethylen har også forskellige kemiske egenskaber. Ethan er et relativt ureaktivt molekyle, mens ethylen er mere reaktivt. Ethylen er mere tilbøjelige til at gennemgå kemiske reaktioner, såsom forbrænding og polymerisation.
4. Bruger
Ethan bruges primært som brændstof. Det bruges også til fremstilling af andre kemikalier, såsom ethylen. Ethylen er et af de vigtigste kemikalier i verden. Det bruges til at producere en lang række produkter, herunder plast, fibre og opløsningsmidler.
Sammenfattende er ethan og ethylen to forskellige kulbrinter med forskellige strukturer, fysiske egenskaber, kemiske egenskaber og anvendelser.
 Varme artikler
Varme artikler
-
 Forskere kan tilpasse hulrum i nyt porøst materialeBillede af det porøse materiale i tværsnit forstørret 29.000 gange. Den hvide streg er guldpladen, som materialet er bygget op på. Kredit:Martin Ratsch Forskere ved Göteborgs Universitet har fremst
Forskere kan tilpasse hulrum i nyt porøst materialeBillede af det porøse materiale i tværsnit forstørret 29.000 gange. Den hvide streg er guldpladen, som materialet er bygget op på. Kredit:Martin Ratsch Forskere ved Göteborgs Universitet har fremst -
 Nyt superomnifobisk glas svæver højt på sommerfuglevingerne ved hjælp af maskinlæringKredit:CC0 Public Domain Glas til teknologier som displays, tabletter, bærbare computere, smartphones, og solceller skal passere lys igennem, men kunne drage fordel af en overflade, der afviser va
Nyt superomnifobisk glas svæver højt på sommerfuglevingerne ved hjælp af maskinlæringKredit:CC0 Public Domain Glas til teknologier som displays, tabletter, bærbare computere, smartphones, og solceller skal passere lys igennem, men kunne drage fordel af en overflade, der afviser va -
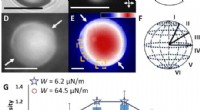 Programmering af van der Waals interaktioner med komplekse symmetrier til mikropartikler ved hjælp …Bipolære LC mikropartikler, eksperimenter, og teoretiske forudsigelser. Repræsentative (A) lysfelt- og (B) polariserede lysmikrofotografier (dobbelthovedede pile viser orienteringer af polarisatorer)
Programmering af van der Waals interaktioner med komplekse symmetrier til mikropartikler ved hjælp …Bipolære LC mikropartikler, eksperimenter, og teoretiske forudsigelser. Repræsentative (A) lysfelt- og (B) polariserede lysmikrofotografier (dobbelthovedede pile viser orienteringer af polarisatorer) -
 Direkte syntese af azulen fortsætter med at afsløre lokkende egenskaberDen blå farve er svær at observere i sin krystalform. Azulene udsender en lugt, der ligner mølkugler. Kredit:Shinshu University Azulen er et ret pænt stof. Som navnet antyder, det viser en ejendom
Direkte syntese af azulen fortsætter med at afsløre lokkende egenskaberDen blå farve er svær at observere i sin krystalform. Azulene udsender en lugt, der ligner mølkugler. Kredit:Shinshu University Azulen er et ret pænt stof. Som navnet antyder, det viser en ejendom
- Måling af massetallet af super tung, menneskeskabte elementer
- Migranter står over for en afvejning mellem status og fertilitet
- Hvad forårsagede ildkuglerne, der lyste himlen op over Australien?
- Forskere opdager verdens nordligste ø
- ESA vælger Harmony som tiende Earth Explorer-mission
- Undersøgelse af virksomheders returneringspolitikker giver vejledning om priser, vender tilbage, ti…


