Hvordan dissocierer en svag base?
$$B + H_2O ⇌ BH^+ + OH^-$$
hvor B repræsenterer den svage base, BH+ er dens konjugerede syre, og OH- er hydroxidionen.
I hvor høj grad en svag base dissocierer i vand, bestemmes af dens dissociationskonstant (Kb). Kb-værdien er et mål for styrken af en base, og den er defineret som forholdet mellem koncentrationen af dissociationsprodukterne (BH+ og OH-) og koncentrationen af reaktanterne (B og H2O) ved ligevægt.
$$K_b =\frac{[BH^+][OH^-]}{[B][H_2O]}$$
Jo større Kb-værdien er, jo stærkere er basen. Svage baser har typisk Kb-værdier mindre end 1.
Dissociationen af en svag base kan påvirkes af flere faktorer, herunder temperatur, pH og tilstedeværelsen af andre ioner i opløsning.
- Temperatur: Dissociationen af en svag base er normalt begunstiget af højere temperaturer. Det skyldes, at højere temperaturer øger molekylernes kinetiske energi, hvilket gør det lettere for dem at bryde fra hinanden og adskilles.
- pH: Dissociationen af en svag base påvirkes også af opløsningens pH. I sure opløsninger er koncentrationen af H+ ioner høj, hvilket konkurrerer med BH+ ionerne om OH- ioner. Dette reducerer dissociationen af den svage base. I basiske opløsninger er koncentrationen af H+ ioner lav, hvilket gør, at BH+ ionerne lettere kan reagere med OH- ioner og danne vand. Dette øger dissociationen af den svage base.
- Tilstedeværelse af andre ioner: Dissociationen af en svag base kan også påvirkes af tilstedeværelsen af andre ioner i opløsning. Nogle ioner, såsom Ca2+ og Mg2+, kan danne komplekser med hydroxidionerne, hvilket reducerer koncentrationen af OH-ioner og forskyder ligevægten mod den udissocierede base. Andre ioner, såsom Cl- og NO3-, har ringe effekt på dissocieringen af svage baser.
Overordnet set er dissociationen af en svag base en kompleks proces, der er påvirket af flere faktorer. Ved at forstå disse faktorer er det muligt at kontrollere og forudsige adfærden af svage baser i forskellige kemiske systemer.
Sidste artikelHvordan dannes ionbindinger?
Næste artikelEn uorganisk base dissocierer i vand til?
 Varme artikler
Varme artikler
-
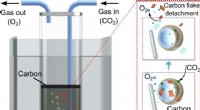 Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U
Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U -
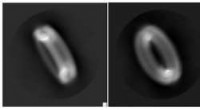 Guardians of the Ring—Forskere afslører strukturen af protein involveret i inflammatoriske sygdom…Cryo-EM-teknologi fangede elegante detaljer i gasdermin-poren. Kredit:Wu lab Når kroppen opdager en trussel, det være sig en viral invader eller en Alzheimers sygdom plaque, guardian proteiner på
Guardians of the Ring—Forskere afslører strukturen af protein involveret i inflammatoriske sygdom…Cryo-EM-teknologi fangede elegante detaljer i gasdermin-poren. Kredit:Wu lab Når kroppen opdager en trussel, det være sig en viral invader eller en Alzheimers sygdom plaque, guardian proteiner på -
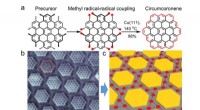 Syntese på overfladen af grafenmolekyler og deres supergitterFigur viser transformationen fra precursor-molekylet til det atomisk præcise circumcoronen-supergitter. (a) Precursormolekylet gennemgår en kemisk cyclodehydrogeneringsproces med brug af kobber (111)
Syntese på overfladen af grafenmolekyler og deres supergitterFigur viser transformationen fra precursor-molekylet til det atomisk præcise circumcoronen-supergitter. (a) Precursormolekylet gennemgår en kemisk cyclodehydrogeneringsproces med brug af kobber (111) -
 Katalysatorer fundet til at omdanne kuldioxid til brændstofKredit:CC0 Public Domain Målet med at tackle den globale opvarmning ved at omdanne kuldioxid til brændstof kunne være et skridt nærmere, når forskere bruger en supercomputer til at identificere en
Katalysatorer fundet til at omdanne kuldioxid til brændstofKredit:CC0 Public Domain Målet med at tackle den globale opvarmning ved at omdanne kuldioxid til brændstof kunne være et skridt nærmere, når forskere bruger en supercomputer til at identificere en
- For smuk til byggeri? Afdækning af kønsbias ved ansættelse af 'maskuline' job
- Ørreder i mineforurenede floder er genetisk isolerede, viser ny undersøgelse
- Teknik til at skabe medicin fri for bivirkninger
- Hvordan og hvorfor NASA giver et navn til hvert sted, det studerer på Mars
- Forskere finder en enkel og billig måde at masseproducere grafen-nanosheets
- Er en natriumkaliumpumpe aktiv eller passiv transport og beskriv hvorfor.?


