Hvorfor falder opløseligheden af en gas generelt med en stigning i temperaturen?
Kinetisk energi og molekylær bevægelse:Når temperaturen stiger, stiger den kinetiske energi af gasmolekyler. Dette resulterer i hurtigere bevægelse og flere kollisioner mellem gasmolekyler og væskemolekyler. Den øgede molekylære bevægelse gør det sværere for gasmolekyler at blive opløst og forblive fanget i væsken.
Gasudvidelse og nedsat massefylde:Når temperaturen stiger, får gasmolekylerne mere energi og bevæger sig hurtigere. Dette får gassen til at udvide sig og blive mindre tæt. Efterhånden som gassens densitet falder, falder dens opløselighed i væsken også.
Forbedrede intermolekylære interaktioner:Ved højere temperaturer bliver de intermolekylære interaktioner mellem flydende molekyler stærkere. Denne øgede sammenhæng i væsken gør det sværere for gasmolekyler at trænge ind og opløses i væsken.
Damptryk:Når temperaturen stiger, stiger gassens damptryk også. Det betyder, at flere gasmolekyler slipper ud af væsken og går over i gasfasen. Det højere damptryk reducerer mængden af gas, der kan forblive opløst i væsken.
Det er dog værd at bemærke, at der er undtagelser fra denne generelle regel. Nogle gasser, såsom brint og oxygen, udviser øget opløselighed i væsker med stigende temperatur. Denne adfærd tilskrives specifikke interaktioner og kemiske reaktioner mellem gasmolekylerne og væsken.
Sammenfattende tilskrives faldet i gasopløselighed med stigende temperatur primært den øgede kinetiske energi, nedsatte gasdensitet, forbedrede intermolekylære interaktioner i væsken og øget damptryk af gassen.
Sidste artikelAntal protoner i et atom?
Næste artikelHvordan adskiller en fraktioneringssøjle råolie i forskellige dele?
 Varme artikler
Varme artikler
-
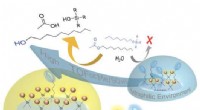 Nøglebeviser, der forbinder hydrofobicitet med effektiv syrekatalyseForenklet skematisk, der viser, hvordan alkylacetater med lange haler ikke kan nærme sig sure sulfo-steder (blå skiver) i hydrofile miljøer; imidlertid, de kan nærme sig hydrofobe miljøer med flere me
Nøglebeviser, der forbinder hydrofobicitet med effektiv syrekatalyseForenklet skematisk, der viser, hvordan alkylacetater med lange haler ikke kan nærme sig sure sulfo-steder (blå skiver) i hydrofile miljøer; imidlertid, de kan nærme sig hydrofobe miljøer med flere me -
 Genredigeringsteknik gør det muligt for silkeorme at producere edderkoppesilkeEn analyse af transformerede kokoner. Morfologi af WT-1, FibH+/-, FibH-/-, WT-2, MaSp1+/-, og MaSp1+/+ kokoner. Målestok repræsenterer 1 cm. Kredit:Jun Xu Et team af forskere tilknyttet flere inst
Genredigeringsteknik gør det muligt for silkeorme at producere edderkoppesilkeEn analyse af transformerede kokoner. Morfologi af WT-1, FibH+/-, FibH-/-, WT-2, MaSp1+/-, og MaSp1+/+ kokoner. Målestok repræsenterer 1 cm. Kredit:Jun Xu Et team af forskere tilknyttet flere inst -
 At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom
At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom -
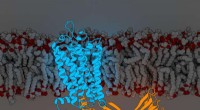 Virkninger af et stort lægemiddelmål reguleret gennem molekylære koderRhodopsinarrestin. Kredit:Parker de Waal, Xu Laboratory, Van Andel Research Institute Et hold med Van Andel Research Institute-forskere i spidsen har besvaret et mangeårigt spørgsmål, der kan føre
Virkninger af et stort lægemiddelmål reguleret gennem molekylære koderRhodopsinarrestin. Kredit:Parker de Waal, Xu Laboratory, Van Andel Research Institute Et hold med Van Andel Research Institute-forskere i spidsen har besvaret et mangeårigt spørgsmål, der kan føre
- EPA-handling øger græsrodsdriften for at reducere for evigt giftige kemikalier
- Vil du holde en ko glad? AI, robotteknologi kunne holde svaret
- Hvad ligner mineralsk spiritus?
- Forskere afslører naturen af jordvand og dets faseovergang
- Har plast et lavere smeltepunkt end metaller?
- Politiets engagement er vigtigt for at håndtere vanskelige grupper af unge


