2 liter N2 og H2 ved fuldstændig reaktion ville give liter NH3?
Lad os først skrive den afbalancerede kemiske ligning for reaktionen mellem N2 og H2 for at danne NH3:
$$N_2 + 3H_2 \højrepil 2NH_3$$
Dernæst skal vi bestemme den begrænsende reaktant. For at gøre dette skal vi sammenligne antallet af mol af hver reaktant.
Ved STP (0 °C og 1 atm) indeholder 1 liter N2 (1 L / 22,4 L/mol) =0,0446 mol N2, og 1 liter H2 indeholder (1 L / 22,4 L/mol) =0,0446 mol af H2.
Baseret på den afbalancerede kemiske ligning, reagerer 1 mol N2 med 3 mol H2. Derfor har vi brug for 0,0446 mol * 3 =0,1338 mol H2 for at reagere fuldstændigt med 0,0446 mol N2.
Da vi kun har 0,0446 mol H2, er det den begrænsende reaktant.
Nu kan vi bruge støkiometrien af den afbalancerede kemiske ligning til at bestemme, hvor mange mol NH3 der vil blive produceret.
Da 1 mol H2 reagerer for at producere 2 mol NH3, vil 0,0446 mol H2 producere 0,0446 mol * 2 =0,0892 mol NH3.
Endelig kan vi bruge den ideelle gaslov til at bestemme mængden af produceret NH3. Ved STP fylder 1 mol af enhver gas 22,4 liter. Derfor vil 0,0892 mol NH3 optage 0,0892 mol * 22,4 L/mol =1,99 liter.
Derfor ville 2 liter N2 og H2 ved fuldstændig reaktion give 1,99 liter NH3.
Sidste artikelHvordan laves krystalglas?
Næste artikelSkriv en ligning for dannelsen af NH3 g fra dets grundstoffer i standardtilstande?
 Varme artikler
Varme artikler
-
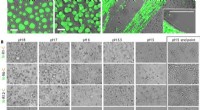 Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis
Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis -
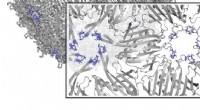 Afsløring af reglerne bag virusstilladskonstruktionForskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University Et team af forskere, herunder Northwestern Engineering-fakult
Afsløring af reglerne bag virusstilladskonstruktionForskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University Et team af forskere, herunder Northwestern Engineering-fakult -
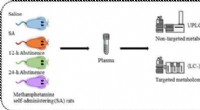 En rottehjerne, til og fra metamfetaminKredit:American Chemical Society Stofmisbrug er en ond cirkel af belønning og tilbagetrækning. Kroniske brugere får ofte tilbagefald på grund af de ubehagelige fysiske og psykiske symptomer, de op
En rottehjerne, til og fra metamfetaminKredit:American Chemical Society Stofmisbrug er en ond cirkel af belønning og tilbagetrækning. Kroniske brugere får ofte tilbagefald på grund af de ubehagelige fysiske og psykiske symptomer, de op -
 Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg
Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg
- Japanske tyfonområder flyvninger, skader tre
- Hayabusa2 dropper målmarkør på asteroiden Ryugu
- 3 millioner Candle Power Spot Light Vs. 600 Lumen Spotlight
- I det sydlige Kina vælter silkeormebønder sig fra dødbringende oversvømmelser
- Opdrættede fisk og skaldyr og husdyr stables forskelligt ved hjælp af alternativ fodereffektivitet
- Grøn brint:Forskning for at øge effektiviteten


