Hvorfor bøjes en ionforbindelse?
Ionkrystaller er typisk stive og sprøde på grund af de stærke elektrostatiske kræfter mellem de modsat ladede ioner. Disse kræfter holder ionerne i faste positioner, hvilket forhindrer dem i at bøje eller deformere.
I modsætning hertil kan kovalente forbindelser, som holdes sammen af kovalente bindinger, ofte bøje eller bøje, fordi de kovalente bindinger giver mulighed for en vis grad af bevægelse og fleksibilitet mellem atomerne.
Sidste artikelHvad er tilsætningen af hydrogen over en dobbeltbinding?
Næste artikelEr chloreddikesyre en svag eller stærk syre?
 Varme artikler
Varme artikler
-
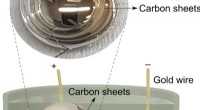 Flydende metaller nedbryder organiske brændstoffer til ultratynde grafitpladerKredit:University of New South Wales For første gang, forskere ved University of New South Wales (UNSW), Sydney, Australien, har demonstreret syntesen af ultratynde grafitiske materialer ved stu
Flydende metaller nedbryder organiske brændstoffer til ultratynde grafitpladerKredit:University of New South Wales For første gang, forskere ved University of New South Wales (UNSW), Sydney, Australien, har demonstreret syntesen af ultratynde grafitiske materialer ved stu -
 Molekylær dynamiksimulering kaster nyt lys over metanhydratdannelseMethanhydrat hentet fra havbunden ud for Oregons kyst, USA. Kredit:Wikimedia Commons I et papir, der blev offentliggjort i denne uge i PNAS , forskere ved University of Amsterdams Van t Hoff Ins
Molekylær dynamiksimulering kaster nyt lys over metanhydratdannelseMethanhydrat hentet fra havbunden ud for Oregons kyst, USA. Kredit:Wikimedia Commons I et papir, der blev offentliggjort i denne uge i PNAS , forskere ved University of Amsterdams Van t Hoff Ins -
 Patienter skal springe laboratoriet over, få øjeblikkelige resultater med ny blodprøveteknologiFørste mobile version af Enzyme Linked Immunosorbent Assay (ELISA), guldstandarden i biokemisk analyse. Kredit:Arsenii Zhdanov De ofte dyre, tidskrævende proces med at få blodprøver og urinanalyse
Patienter skal springe laboratoriet over, få øjeblikkelige resultater med ny blodprøveteknologiFørste mobile version af Enzyme Linked Immunosorbent Assay (ELISA), guldstandarden i biokemisk analyse. Kredit:Arsenii Zhdanov De ofte dyre, tidskrævende proces med at få blodprøver og urinanalyse -
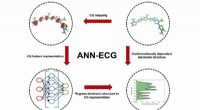 Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato
Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato
- NASA robottankningsmission afgår fra stationen
- Mødre føler sig presset af madlavningspligt
- Typer af genetiske krydser
- Hvordan man opbygger en vulkan til en parade Float
- Hvor mange kovalente bindinger har c2h2-molekylet?
- Kan geoingeniering af solenergi dæmpe både klimaændringer og ulighed i indkomst?


