Hvad Hvad forårsager kemiske reaktioner ifølge moderne kemi?
1. Kemisk binding :Kemiske reaktioner involverer dannelse og brydning af kemiske bindinger mellem atomer. Disse bindinger dannes, når atomer deler eller overfører elektroner for at opnå en mere stabil elektronisk konfiguration. Når atomer bringes tæt på hinanden, kan deres yderste elektroner interagere og danne nye bindinger, hvilket fører til dannelsen af nye molekyler eller forbindelser.
2. Energiændringer :Kemiske reaktioner involverer ændringer i energitilstandene for de deltagende atomer eller molekyler. For at en reaktion kan forekomme, skal reaktanterne overvinde en aktiveringsenergibarriere. Denne energibarriere kan overvindes ved at tilføje varme, lys eller en katalysator. Produkterne fra reaktionen har normalt lavere energi end reaktanterne, og frigiver energi i form af varme eller lys.
3. Elektronegativitet og polaritet :Elektronegativitet er et atoms evne til at tiltrække elektroner. Når atomer med forskellige elektronegativiteter binder, skaber de en polær binding, hvor elektronerne er ulige fordelt. Denne polaritet kan påvirke molekylets reaktivitet og dets interaktioner med andre molekyler. Polære molekyler har en tendens til at være mere reaktive end ikke-polære molekyler.
4. Kollisionsteori :Kollisionsteorien siger, at for at der kan opstå en kemisk reaktion, skal reaktantpartiklerne kollidere med hinanden effektivt. Disse kollisioner skal have tilstrækkelig energi og den korrekte orientering, for at reaktionen kan finde sted. Faktorer som temperatur, koncentration og overfladeareal kan påvirke hyppigheden og effektiviteten af kollisioner.
5. Reaktionsoverflade og overgangstilstand :Reaktionsfladen repræsenterer de energiændringer, der sker under en kemisk reaktion. Det højeste punkt på reaktionsfladen kaldes overgangstilstanden. Reaktanterne skal overvinde denne energibarriere for at nå produkterne. Overgangstilstanden er et afgørende trin i reaktionsmekanismen, og dens energi bestemmer reaktionshastigheden.
6. Katalysatorer :Katalysatorer er stoffer, der øger hastigheden af en kemisk reaktion uden at blive forbrugt i processen. De sænker reaktionens aktiveringsenergi ved at give en alternativ vej for reaktanterne til at omdanne til produkter. Katalysatorer kan være homogene (til stede i samme fase som reaktanterne) eller heterogene (til stede i en anden fase, såsom en fast katalysator i en flydende reaktionsblanding).
Disse er nøglefaktorerne, der bidrager til kemiske reaktioner ifølge moderne kemi. Ved at forstå disse grundlæggende principper kan videnskabsmænd forudsige, analysere og kontrollere kemiske reaktioner til forskellige anvendelser inden for industri, medicin, energi og materialevidenskab.
 Varme artikler
Varme artikler
-
 Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de
Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de -
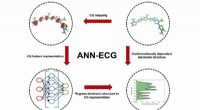 Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato
Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato -
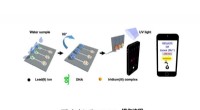 Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati
Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati -
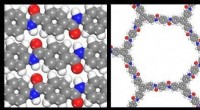 Samarbejde fører til 2-D polymer opdagelseKredit:The Army Research Laboratory Hærens forskere nåede et gennembrud i den begyndende videnskab om todimensionelle polymerer takket være et samarbejdsprogram, der får hjælp fra ledende videnska
Samarbejde fører til 2-D polymer opdagelseKredit:The Army Research Laboratory Hærens forskere nåede et gennembrud i den begyndende videnskab om todimensionelle polymerer takket være et samarbejdsprogram, der får hjælp fra ledende videnska
- Hvilken type molekyler interagerer med vand polært eller upolært?
- Ny teori lover at omforme, hvordan vi tænker om polymeroverbygninger
- Evolutionens brændstof:En ny hypotese om, hvordan komplekst liv opstod på Jorden
- Science publicering er åbnet op under coronavirus-pandemien. Det vil ikke være nemt at holde det s…
- Lava, der flyder ud i havet, skaber delta, udvider spansk ø
- Hvorfor detailhandlere vil have dig til at vide om deres grønne legitimationsoplysninger


