En ligevægtsblanding indeholder n2o4 p er lig med 0,30 ATM og no2 1,1atm ved 350 k volumen af beholderen fordobles konstant temperatur Hvilke tryk?
PN2O4 =0,30 atm
PNO2 =1,1 atm
Ligevægtskonstant ved 350 K:
Kp =[NO2]^2/[N2O4] =(1,1 atm)^2/0,30 atm =4,07 atm.
Ved ligevægt, lad partialtrykket for N2O4 og NO2 være henholdsvis x atm og y atm.
Kp =[NO2]^2/[N2O4] =y^2/x =4,07 atm
Da beholderens volumen er fordoblet, vil partialtrykket af N2O4 og NO2 hver halveres:
x =PN2O4 =0,30 atm / 2 =0,15 atm
y =PNO2 =1,1 atm / 2 =0,55 atm
Derfor er ligevægtstrykkene:
PN2O4 =0,15 atm
PNO2 =0,55 atm
Sidste artikelEr oxygen dannet af polære kovalente bindinger?
Næste artikelHvad er konjugatsyren for H20?
 Varme artikler
Varme artikler
-
 Stabilisering af 2-D lagdelte perovskiter til fotovoltaik:Opsætning af en forsvarsmurSammenligning af RP og DJ fase 2D lagdelte perovskit strukturer. Kredit:DICP At opsætte en forsvarsmur i en fodboldkamp er en primær sportsudfordring. Ingen træner kan lide et hul mellem defensive
Stabilisering af 2-D lagdelte perovskiter til fotovoltaik:Opsætning af en forsvarsmurSammenligning af RP og DJ fase 2D lagdelte perovskit strukturer. Kredit:DICP At opsætte en forsvarsmur i en fodboldkamp er en primær sportsudfordring. Ingen træner kan lide et hul mellem defensive -
 Forskere laver virusbekæmpende ansigtsmaskerGrafisk abstrakt. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.2c04165 Forskere fra Rensselaer Polytechnic Institute har udviklet en tilgængelig måde at gøre N95-ansigtsmaske
Forskere laver virusbekæmpende ansigtsmaskerGrafisk abstrakt. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.2c04165 Forskere fra Rensselaer Polytechnic Institute har udviklet en tilgængelig måde at gøre N95-ansigtsmaske -
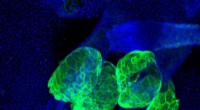 Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og
Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og -
 Ny teknik sporer individuel proteinbevægelse på levende cellerInterferometrisk spredningsmikroskopi (iSCAT) muliggør hurtig 3D-sporing af individuelle guld-nanopartikelmærkede proteiner på det dynamiske terræn af den levende cellemembran. Kredit:Richard Taylor.
Ny teknik sporer individuel proteinbevægelse på levende cellerInterferometrisk spredningsmikroskopi (iSCAT) muliggør hurtig 3D-sporing af individuelle guld-nanopartikelmærkede proteiner på det dynamiske terræn af den levende cellemembran. Kredit:Richard Taylor.
- Tidligste skovbrande beviser for gammel træudvidelse
- Ny kræftovervågningsteknologi i guld værd
- Ny amerikansk lov ændrer regler for grænseoverskridende dataanmodninger
- Forskning låser op for indfødte gnaveres hemmeligheder, rotterace til nye lande
- Hvordan migrantarbejdere er kritiske for fremtiden for Australiens landbrugsindustri
- Hvordan naturen bygger brintproducerende enzymer


