Hvad sker der, når du blander ammoniumnitrat med vand?
1. Opløsning:Ammoniumnitrat er en meget opløselig forbindelse. Når det kommer i kontakt med vand, omgiver og hydrerer de polære vandmolekyler de ioniske Ammonium(NH4+) og Nitrat(NO3-) ioner. Dette bryder krystalgitteret af ammoniumnitrat fra hinanden, så ionerne kan spredes jævnt i vandet.
2. Ionisering:Når det er opløst, dissocieres ammoniumnitratet til dets bestanddele. Ammoniumionen (NH4+) og Nitrationen (NO3-) bliver fri til at bevæge sig uafhængigt i opløsningen.
3. Hydrering af ioner:Vandmolekyler omgiver og hydrerer ammonium- og nitrat-ionerne og danner hydreringskugler. Disse hydreringssfærer stabiliserer ionerne i opløsning og forhindrer dem i at rekombinere til ammoniumnitratkrystaller.
4. Kemiske reaktioner:I vand kan ammoniumnitrat gennemgå forskellige kemiske reaktioner afhængigt af forholdene og tilstedeværelsen af andre stoffer. For eksempel kan det i sure opløsninger reagere med hydrogenioner (H+) og danne salpetersyre (HNO3) og ammoniumioner (NH4+).
5. Temperatureffekter:Opløseligheden af ammoniumnitrat stiger med temperaturen. Når temperaturen af vandet stiger, kan mere ammoniumnitrat opløses, hvilket resulterer i en mere koncentreret opløsning.
6. Kølende effekt:Opløsning af ammoniumnitrat i vand forårsager en endoterm reaktion (en reaktion, der absorberer varme). Det betyder, at varme absorberes fra omgivelserne for at lette opløsningsprocessen. Som et resultat kan opløsningen og beholderen føles kølige at røre ved.
Bemærk venligst, at ammoniumnitrat, især i høje koncentrationer, skal håndteres med forsigtighed. Det er almindeligt anvendt som gødning i landbruget, men det er også kendt som et oxidationsmiddel og kan være potentielt eksplosivt under visse forhold. Derfor er det vigtigt at følge sikkerhedsretningslinjer og korrekte håndteringsprocedurer, når du arbejder med ammoniumnitrat.
 Varme artikler
Varme artikler
-
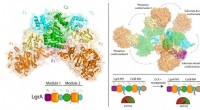 Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af
Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af -
 Discovery tilpasser naturlig membran til at lave brintbrændstof fra vandTo membranbundne proteinkomplekser, der arbejder sammen med en syntetisk katalysator for at producere brint fra vand. Kredit:Olivia Johnson og Lisa Utschig En kemisk reaktionsvej, der er central f
Discovery tilpasser naturlig membran til at lave brintbrændstof fra vandTo membranbundne proteinkomplekser, der arbejder sammen med en syntetisk katalysator for at producere brint fra vand. Kredit:Olivia Johnson og Lisa Utschig En kemisk reaktionsvej, der er central f -
 Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator
Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator -
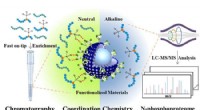 Forskere skræddersyr hurtig og effektiv N-phosphopeptides berigelsesstrategiBis (zink (II) -dipicolylamin) -funktionaliseret sub-2 μm core-shell mikrosfærer til analyse af N-phosphoproteom. Kredit:JIANG Bo og HU Yechen Protein N-phosphorylering spiller en kritisk rolle i
Forskere skræddersyr hurtig og effektiv N-phosphopeptides berigelsesstrategiBis (zink (II) -dipicolylamin) -funktionaliseret sub-2 μm core-shell mikrosfærer til analyse af N-phosphoproteom. Kredit:JIANG Bo og HU Yechen Protein N-phosphorylering spiller en kritisk rolle i
- Lysende gammastråling detekteret fra blazaren DA 193
- Forskning giver træer en fordel i forbindelse med oprydning af lossepladser
- Varmere Jord kunne se mindre sommerfugle, der kæmper for at flyve, hvilket påvirker fødesystemer
- Digitale nomader ønsker at erstatte nationalstaten – er der en mørkere side af denne søgen efter …
- Brug kunstig intelligens til at forstå vulkanudbrud fra lille aske
- Havets liv i 3-D:Kortlægning af fytoplankton med en smart AUV


