Leder natriumchlorid elektricitet i opløsning?
Når natriumchlorid opløses i vand, brydes ionbindingerne mellem natrium- og chloridioner. Natrium- og chloridionerne bliver derefter adskilt og omgivet af vandmolekyler. Disse ioner kan frit bevæge sig rundt i opløsningen, og de kan føre en elektrisk strøm. Dette er grunden til, at natriumchlorid er en god leder af elektricitet i opløsning.
Mængden af elektricitet, som en opløsning af natriumchlorid kan lede, afhænger af opløsningens koncentration. Jo mere koncentreret opløsningen er, jo flere ioner er der i opløsningen, og jo bedre kan opløsningen lede elektricitet.
Sidste artikelHvad er molmassen af PbNO3 2?
Næste artikelHvorfor bruges ligevægtspile i ioniseringsligningerne for nogle syrer?
 Varme artikler
Varme artikler
-
 Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelseIllustration af de anvendte matematiske transformationer, først på billedet af et skakbræt, derefter på mikrofluidiske multipoler. Kredit:Polytechnique Montréal og McGill University Professor Thom
Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelseIllustration af de anvendte matematiske transformationer, først på billedet af et skakbræt, derefter på mikrofluidiske multipoler. Kredit:Polytechnique Montréal og McGill University Professor Thom -
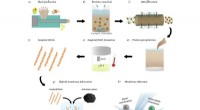 Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru
Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru -
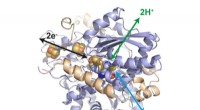 Enzymsystem til brintindustrienStruktur af hydrogenasen fra Desulfovibrio desulfuricans. I sit aktive center, en jern-svovl-klynge katalyserer oxidation af hydrogen til protoner samt reduktion af protoner til hydrogen. Yderligere j
Enzymsystem til brintindustrienStruktur af hydrogenasen fra Desulfovibrio desulfuricans. I sit aktive center, en jern-svovl-klynge katalyserer oxidation af hydrogen til protoner samt reduktion af protoner til hydrogen. Yderligere j -
 Nye fingeraftryk tilføjet til kemisk identifikationsdatabaseNIST -forskningskemiker Kelly Telu injicerer en prøve i et massespektrometer, et laboratorieinstrument, som forskere bruger til at identificere ukendte kemiske forbindelser. Kredit:M. Delorme/NIST
Nye fingeraftryk tilføjet til kemisk identifikationsdatabaseNIST -forskningskemiker Kelly Telu injicerer en prøve i et massespektrometer, et laboratorieinstrument, som forskere bruger til at identificere ukendte kemiske forbindelser. Kredit:M. Delorme/NIST
- Nye potente analoger af plantehormon giver tørkestresslindring for afgrøder
- Optimering af netværkssoftware til at fremme videnskabelig opdagelse
- En ny type brand, brændstoffremtiden?
- Årsag og effektvidenskabsprojekter
- En ny undersøgelse afslører, at kvantefysik kan forårsage mutationer i vores DNA
- NASAs Voyager 1 fortsætter med at sende tekniske opdateringer til Jorden


