Har stærk base en konjugeret syre?
En stærk base er et stof, der dissocierer fuldstændigt i vand for at producere hydroxidioner (OH-) og dens konjugerede syre. Den konjugerede syre af en stærk base er den art, der dannes, når basen accepterer en proton (H+). For eksempel er den konjugerede syre i den stærke base natriumhydroxid (NaOH) vand (H2O). Dette skyldes, at når NaOH opløses i vand, opløses det fuldstændigt til Na+ og OH- ioner. OH-ionerne kan derefter reagere med vandmolekyler og danne H2O og hydroxidioner.
Styrken af en konjugatsyre er omvendt relateret til styrken af dens tilsvarende base. Det betyder, at jo stærkere basen er, jo svagere er dens konjugerede syre og omvendt. For eksempel er konjugatsyren i den svage base ammoniak (NH3) ammoniumionen (NH4+), som er en relativt stærk syre. Dette skyldes, at NH3 kun er delvist dissocieret i vand, så der er færre NH4+ ioner til stede i opløsning til at reagere med hydroxidioner og danne vand.
Generelt er de konjugerede syrer af stærke baser ikke særlig sure. Der er dog nogle undtagelser fra denne regel. For eksempel er konjugatsyren af den stærke base natriumhydrid (NaH) hydrogengas (H2), som er en meget stærk syre. Dette skyldes, at NaH er en meget stærk base, så der er meget få H-ioner til stede i opløsning til at reagere med hydroxidioner og danne vand.
 Varme artikler
Varme artikler
-
 Konstrueret protein inspireret af naturen kan hjælpe med plastikpestMutationer af et PET-hydrolyserende enzym PET2 resulterede i en stigning på 6,7 grader C i termisk stabilitet og en 6,8 gange stigning i PET-hydrolytisk aktivitet. T m repræsenterer smeltetemperatur
Konstrueret protein inspireret af naturen kan hjælpe med plastikpestMutationer af et PET-hydrolyserende enzym PET2 resulterede i en stigning på 6,7 grader C i termisk stabilitet og en 6,8 gange stigning i PET-hydrolytisk aktivitet. T m repræsenterer smeltetemperatur -
 En olieædende bakterie, der kan rense forurening og spildProfessor Satinder Kaur Brar ved Environmental Biotechnology Laboratory. Kredit:Institut national de la recherche scientifique Olieudslip og deres indvirkning på miljøet er en kilde til bekymring
En olieædende bakterie, der kan rense forurening og spildProfessor Satinder Kaur Brar ved Environmental Biotechnology Laboratory. Kredit:Institut national de la recherche scientifique Olieudslip og deres indvirkning på miljøet er en kilde til bekymring -
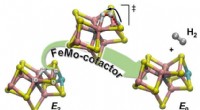 Kemikere afslører en mekanisme for dihydrogenproduktion af nitrogenaseSkematisk illustration af, hvordan H2 dannes ud fra et af de enzymatiske reaktionsmellemprodukter (E2) for at regenerere hviletilstanden (E0) af den nitrogenase-katalytiske cofaktor, kaldet FeMo-kofak
Kemikere afslører en mekanisme for dihydrogenproduktion af nitrogenaseSkematisk illustration af, hvordan H2 dannes ud fra et af de enzymatiske reaktionsmellemprodukter (E2) for at regenerere hviletilstanden (E0) af den nitrogenase-katalytiske cofaktor, kaldet FeMo-kofak -
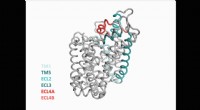 Neurovidenskabsmænd opdager ny struktur af vigtigt protein i hjernenAnimation af LeuT-transporterens fire trin sat sammen til en fuld cyklus. Kredit:Københavns Universitet Efter fem års eksperimenter, Det er lykkedes forskere fra Københavns Universitet at udkrysta
Neurovidenskabsmænd opdager ny struktur af vigtigt protein i hjernenAnimation af LeuT-transporterens fire trin sat sammen til en fuld cyklus. Kredit:Københavns Universitet Efter fem års eksperimenter, Det er lykkedes forskere fra Københavns Universitet at udkrysta
- Indeholder RNA en genetisk kode?
- Lady Luck:Driver antropomorfiseret held risikofyldt økonomisk adfærd?
- Astrofysikere foretager undersøgelser med meget høj energi af en stærkt udvidet pulsarvindåge
- Debat om atomaffald:Forvandle det til glas eller indkapsling i cement?
- Sådan identificeres et vandmoccasin
- Dommedagsur tættere på midnat end nogensinde før


