Kemikere afslører en mekanisme for dihydrogenproduktion af nitrogenase
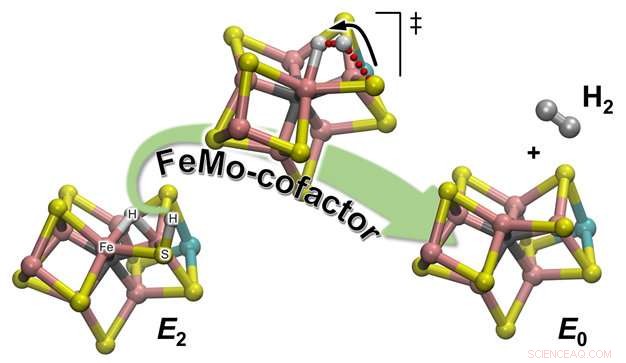
Skematisk illustration af, hvordan H2 dannes ud fra et af de enzymatiske reaktionsmellemprodukter (E2) for at regenerere hviletilstanden (E0) af den nitrogenase-katalytiske cofaktor, kaldet FeMo-kofaktor. Brintatomet, der er bundet til et af svovlatomerne, starter en rejse, der vil tage det for at mødes med partneren, som det vil danne H2-molekylet med:en hydrisk brint, der tålmodigt venter, sidder mellem to Fe-atomer. Kredit:Pacific Northwest National Laboratory
Nitrogenase er centralt for livet på vores planet. Det giver det meste af det nitrogen (N), der bruges i proteiner og nukleinsyrer, og det er vigtigt for at skabe planter, dyr og andre organismer, fremstilling af ammoniak (NH3), som derefter bruges i biosyntesen af aminosyrer og derefter proteiner. Men mens nitrogenase er på arbejde, det skaber også noget andet:dihydrogen (H2). Forskere har i nogen tid vidst, at nitrogenase danner H2 ved to forskellige processer. Nu, en af disse processer er tydelig gennem arbejdet fra et team af forskere, der studerede mekanismen for H2-produktion.
Nitrogenase vil danne H2, hvis den køres i fravær af N2. Dette er blevet betragtet som en "afslapning" af det enzymaktive sted, der er ladet med jernhydrider, der er nødvendige for N2-reduktionsreaktionen. Men hvad er mekanismen for, hvordan nitrogenase-aktive jernhydrider slappede af for at lave denne H2? Et team af forskere fra Pacific Northwest National Laboratory, Utah State University, Northwestern University, og University of Utah søgte at forstå denne H2-relaksationsmekanisme ved at overvåge virkningerne af hydrogen (H) vs deuterium (D) på kinetikken af H2-dannelse, når nitrogenase er knyttet til en elektrode. Holdet opdagede, at en nærliggende H+ faktisk var den aktive partner i produktionen af H2, når den kombineres med jernhydridet for at fremstille H2.
"Kun én proton gør alt, hydridet er blot en tilskuer, der venter på noget action, " bekræftede Simone Raugei, en PNNL-videnskabsmand involveret i dette arbejde.
Dette er et vigtigt skridt i retning af at forstå nitrogenase og hvordan og hvorfor produktionen af H2 er nødvendig for dens aktivitet. Det illustrerer også en strategi for mekanistisk undersøgelse, der kan anvendes på andre oxidoreduktase-enzymer og på biomimetiske komplekser.
For at isolere kinetikken af brintproduktion, et hold ledet af Lance Seefeldt, Brian Hoffman, Shelley Minteer, og Simone Raugei brugte små molekyler til hurtigt at sende elektroner fra en elektrode til den katalytiske halvdel af nitrogenase. At følge protonreaktionerne var en vanskelig og udfordrende opgave, sagde Seefeldt, så for at sikre nøjagtighed overvågede de proton "inventaret" (antallet af hydrogener involveret i den katalytiske produktion af H2) ved at udføre kinetiske brint/deuterium kinetiske målinger.
Resultaterne af eksperimenterne antydede, at kun én brint faktisk var involveret i det hastighedsbegrænsende trin af H2-dannelse, og ikke to, som reaktionens støkiometri indikerer.
Holdets eksperimentelle observationer blev opretholdt gennem beregningskemi, som gav en detaljeret atomistisk beskrivelse af reaktionsmekanismen. Der er 2 typer hydrogener i den katalytiske cofaktor (kaldet FeMo-co):en placeret i en brodannende position, hvor den binder til to jernatomer (et brodannende hydrid), og en på et nærliggende svovlatomligander (dybest set et protoneret svovlatom:S-H). Det viser sig, at under H2-evolutionen, sidstnævnte er den aktive partner. S-H-bindingen brydes, og det resulterende H+ bevæger sig mod brohydridet og protonerer det og danner H2:Beregningerne giver en forklaring på den eksperimentelle observation, at kun én brint er "aktiv, " mens den anden blot er en tilskuer, der venter på sin partners ankomst.
"Niveauet af overensstemmelse mellem observationerne og beregningskemiske resultater var bemærkelsesværdigt højt, sagde Raugei.
Dette arbejde er et kritisk skridt mod en mekanistisk forståelse af nitrogenase-enzymet. Der er stadig arbejde at gøre for at forstå mekanismen i den anden H2-evolutionsproces, der fører til N2-binding, aktivering, og reduktion til NH3.
Sidste artikelFremtiden for plastik – genbruge det dårlige og opmuntre det gode
Næste artikelNy teknologi omdanner biomasse til kul
 Varme artikler
Varme artikler
-
 Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I
Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I -
 DNA-replikation i HPVEsther Biswas-Fiss (til højre) og Subhasis Biswas undersøger genetiske variationer i DNA-replikationsstarterne for HPV og dets sammenhæng med cancer. Et par forskere fra University of Delaware Dep
DNA-replikation i HPVEsther Biswas-Fiss (til højre) og Subhasis Biswas undersøger genetiske variationer i DNA-replikationsstarterne for HPV og dets sammenhæng med cancer. Et par forskere fra University of Delaware Dep -
 Bygning fra gamle bygninger:Nedrivningsaffald bliver til ny betonDet franske firma Keey Aerogel kan producere sin aerogel-varmeisolering til omkring halvdelen af prisen ved at udvinde silica fra affaldsbeton i stedet for at bruge ny silica. Kredit:Keey Aerogel
Bygning fra gamle bygninger:Nedrivningsaffald bliver til ny betonDet franske firma Keey Aerogel kan producere sin aerogel-varmeisolering til omkring halvdelen af prisen ved at udvinde silica fra affaldsbeton i stedet for at bruge ny silica. Kredit:Keey Aerogel -
 Kemikere afslører en mekanisme for dihydrogenproduktion af nitrogenaseSkematisk illustration af, hvordan H2 dannes ud fra et af de enzymatiske reaktionsmellemprodukter (E2) for at regenerere hviletilstanden (E0) af den nitrogenase-katalytiske cofaktor, kaldet FeMo-kofak
Kemikere afslører en mekanisme for dihydrogenproduktion af nitrogenaseSkematisk illustration af, hvordan H2 dannes ud fra et af de enzymatiske reaktionsmellemprodukter (E2) for at regenerere hviletilstanden (E0) af den nitrogenase-katalytiske cofaktor, kaldet FeMo-kofak
- Ny forskning understøtter hypotesen om, at asteroide bidrog til masseudryddelse
- Piano Science Fair Ideas
- Hvad er funktionaliteten af stivelse i planteceller?
- Hvad gør en planet beboelig
- Kaffebønder kæmper for at tilpasse sig Colombias skiftende klima
- Lavtlønsarbejdere i fare for automatisering:undersøgelse


