Hvordan reagerer natriumcarbonat og bicarbonat under titrering?
1. Natriumcarbonat (Na2CO3):
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
I denne reaktion reagerer natriumcarbonat med saltsyre og danner natriumchlorid (NaCl), vand (H2O) og kuldioxidgas. For hver tilstedeværende mol natriumcarbonat frigives et mol kuldioxid.
2. Natriumbicarbonat (NaHCO3):
NaHC03 + HCl → NaCl + H2O + CO2
Natriumhydrogencarbonat reagerer med saltsyre på lignende måde og producerer natriumchlorid, vand og kuldioxidgas. Men da natriumbicarbonat indeholder en bicarbonation (HCO3-) sammenlignet med to carbonationer (CO32-) i natriumcarbonat, frigives kun et halvt mol kuldioxid for hvert mol natriumbicarbonat, der er til stede.
Under titreringen tilsættes syren gradvist til opløsningen indeholdende natriumcarbonat og/eller natriumbicarbonat. Når syren tilsættes, reagerer den med carbonat- og bicarbonationerne, hvilket forårsager frigivelse af kuldioxidgas. Slutpunktet for titreringen nås, når alle carbonat- og bicarbonationerne har reageret med syren, og opløsningen bliver neutral.
Indikatorer, såsom phenolphtalein eller methylorange, bruges ofte til at bestemme slutpunktet for titreringen. Disse indikatorer ændrer farve ved et specifikt pH-område, hvilket signalerer det punkt, hvor syren har reageret fuldstændigt med carbonat- og bicarbonationerne.
Titreringer, der involverer natriumcarbonat og natriumbicarbonat, bruges almindeligvis i analytisk kemi til at bestemme koncentrationen af en ukendt syre ved at måle det volumen af syre, der kræves for at neutralisere en kendt mængde af carbonat/bicarbonatopløsningen.
Sidste artikelReagerer natriumcarbonat med phenolphtalein-indikator?
Næste artikelHvor mange protoner neutroner og elektroner har molybdæn?
 Varme artikler
Varme artikler
-
 Konstruerede defekter i krystallinsk materiale øger den elektriske ydeevneXiaoli Tan og et team af campus-samarbejdspartnere brugte dette transmissionselektronmikroskop på Ames Laboratorys Sensitive Instrument Facility til at studere virkningerne af tekniske defekter i viss
Konstruerede defekter i krystallinsk materiale øger den elektriske ydeevneXiaoli Tan og et team af campus-samarbejdspartnere brugte dette transmissionselektronmikroskop på Ames Laboratorys Sensitive Instrument Facility til at studere virkningerne af tekniske defekter i viss -
 Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S
Forskere optrævler mysterierne om irreversibilitet i elektrokrome tynde filmSmarte vinduer, en af de mest lovende anvendelser af wolframoxid (WO3) tynde film, er transmissionskontrollerbare vinduer, der bruges i biler, fly, og bygningsapplikationer. Kredit:Joel Filipe fra S -
 Engineering levende stilladser til byggematerialerBerkeley Lab -forskere byggede et sæt bakterier, der irreversibelt kan vedhæfte en række hårde eller bløde materialer som biopolymerer eller halvledende nanopartikler til celleoverfladen uden at beska
Engineering levende stilladser til byggematerialerBerkeley Lab -forskere byggede et sæt bakterier, der irreversibelt kan vedhæfte en række hårde eller bløde materialer som biopolymerer eller halvledende nanopartikler til celleoverfladen uden at beska -
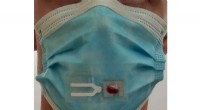 Gør masker smartere og sikrere mod COVID-19Kredit:University of California - San Diego Et nyt værktøj til overvågning af COVID-19 kan en dag være lige under næsen på dig. Forskere ved University of California San Diego er ved at udvikle en
Gør masker smartere og sikrere mod COVID-19Kredit:University of California - San Diego Et nyt værktøj til overvågning af COVID-19 kan en dag være lige under næsen på dig. Forskere ved University of California San Diego er ved at udvikle en
- Sjove eksperimenter til at adskille blandinger
- Fleksibel, lette solceller:Forskere udvikler en ny tilgang ved hjælp af grafenplader overtrukket me…
- Forskere bruger gammelt DNA, historisk kontekst til at optrevle slægtskab, sociale praksisser i Ava…
- Sådan fungerer det amerikanske luftvåben
- Hvor blev Sierra sneen af i foråret? Ikke i Californiens floder og vandforsyninger
- Søger retfærdighed i annoncer:Forsker skitserer, hvordan 'bias-score' kan beregnes online levering…


