Er det nemmere at fjerne en elektron fra en iodidion eller en bromidion?
Dette skyldes, at iodidionen har en større elektronsky end bromidionen. Det betyder, at elektronerne i iodidionen er mere spredt ud og derfor mindre tæt bundet til kernen. Som et resultat er det lettere at fjerne en elektron fra en iodidion end en bromidion.
Jo større anionen er, jo lettere er det at fjerne en elektron.
Dette skyldes, at valenselektronerne er længere væk fra kernen og derfor er mindre tiltrukket af den.
Tendensen i ioniseringsenergi for halogenerne er:
F> Cl> Br> I
Det betyder, at det er lettest at fjerne en elektron fra en iodidion og sværest at fjerne en elektron fra en fluoridion.
Sidste artikelHvad er stærkere diamant eller titanium?
Næste artikelKemisk ligning af det brændende brint?
 Varme artikler
Varme artikler
-
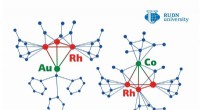 Kemikere foreslår en metode til fremstilling af metalbaserede katalysatorer med uovertruffen effekt…Kredit:RUDN Universitet Et team af kemikere fra RUDN University og Nesmeyanov Institute of Organoelement Compounds (INEOS) syntetiserede to heterometalliske klynger med næsten 100 % effektivitet.
Kemikere foreslår en metode til fremstilling af metalbaserede katalysatorer med uovertruffen effekt…Kredit:RUDN Universitet Et team af kemikere fra RUDN University og Nesmeyanov Institute of Organoelement Compounds (INEOS) syntetiserede to heterometalliske klynger med næsten 100 % effektivitet. -
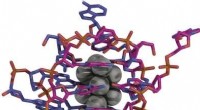 Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som
Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som -
 Voksende krystaller til at generere tilfældige talKredit: Stof (2020). DOI:10.1016/j.matt.2020.01.024 Et team ved University of Glasgow har udviklet en ny måde at generere tilfældige tal ved at bruge tilfældigheden i krystalvækst. I deres papir
Voksende krystaller til at generere tilfældige talKredit: Stof (2020). DOI:10.1016/j.matt.2020.01.024 Et team ved University of Glasgow har udviklet en ny måde at generere tilfældige tal ved at bruge tilfældigheden i krystalvækst. I deres papir -
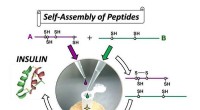 Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
- Midt i Saltonhavets ødemark, en mirakuløs, men udfordrende oase er født
- Hjemby fordel? Administrerende direktører har en tendens til at erhverve virksomheder på velkendte…
- Drik ikke og drøn, siger japanske parlamentsmedlemmer
- Magnetiske nanopartikelkæder tilbyder ny teknik til styring af bløde robotter
- Video:Flyv din satellit!
- Arbejdsgivere opfordres til at omfavne neurodiversitet


