Hvilken type binding er sandsynligvis involveret i prøverne, der ikke var ledere i deres rene form, men førte en strøm, når de blev blandet med vand?
Når en ionforbindelse opløses i vand, omgiver og adskiller vandmolekylerne ionerne og danner en opløsning, der kan lede elektricitet. Dette skyldes, at ionerne er frie til at bevæge sig og bærer en elektrisk ladning. I modsætning hertil er ionerne i en ren ionforbindelse holdt tæt sammen i et krystalgitter og kan ikke bevæge sig frit, så forbindelsen leder ikke elektricitet.
Eksempler på ioniske forbindelser, der ikke leder elektricitet i deres rene form, men som leder elektricitet, når de er opløst i vand, omfatter natriumchlorid (NaCl) og kaliumiodid (KI).
Sidste artikelHvilken type binding forekommer i en prøve ren natrium Na?
Næste artikelEr vanddamp en blanding eller et rent stof?
 Varme artikler
Varme artikler
-
 Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere
Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere -
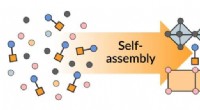 En enkel måde at få komplekse halvledere til at samle sig selvEt diagram viser, hvordan lag af to 2D-materialer – en perovskit (blå) og et metalhalogenid (gul) – samler sig ud af kemikalier, der vælter rundt i vand (til venstre). Forsamlingen styres af linkermol
En enkel måde at få komplekse halvledere til at samle sig selvEt diagram viser, hvordan lag af to 2D-materialer – en perovskit (blå) og et metalhalogenid (gul) – samler sig ud af kemikalier, der vælter rundt i vand (til venstre). Forsamlingen styres af linkermol -
 Et bedre bæredygtigt hygiejnebindSHERO Pad, udviklet af et team af University of Utah materialevidenskab og ingeniørstuderende, er en ny feminin hygiejnepude, der er 100 procent biologisk nedbrydelig og lavet af alle naturlige materi
Et bedre bæredygtigt hygiejnebindSHERO Pad, udviklet af et team af University of Utah materialevidenskab og ingeniørstuderende, er en ny feminin hygiejnepude, der er 100 procent biologisk nedbrydelig og lavet af alle naturlige materi -
 Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima
Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima
- Hvad er hornet af en næsehorn fremstillet af?
- Hvem skal afgøre, hvilke studerende der kommer ind på college - et udvalg eller en computer?
- Udryddelse af koldtvandskoraller på den namibiske sokkel på grund af lavt iltindhold
- Hvordan kan blødt væv eksistere i dinosaurfossiler?
- Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelse
- Sådan fungerer retsmedicinske laboratorieteknikker


