Hvordan adskiller reaktionen af kalium og natrium med koldt vand sig?
Når kaliummetal tilsættes til koldt vand, reagerer det kraftigt og danner kaliumhydroxid (KOH) og brintgas (H2). Reaktionen er meget eksoterm, hvilket betyder, at den frigiver en stor mængde varme. Den genererede varme kan få vandet til at koge og sprøjte, og den producerede brintgas kan være brandfarlig. Derfor er det vigtigt at håndtere kalium med forsigtighed og at udføre reaktionen i et godt ventileret område.
Natrium
I modsætning hertil, når natriummetal tilsættes til koldt vand, er reaktionen mindre kraftig sammenlignet med kalium. Natrium reagerer også med vand for at danne natriumhydroxid (NaOH) og brintgas, men reaktionen forløber med en langsommere hastighed og genererer mindre varme. Den producerede brintgas er stadig brandfarlig, så det er stadig vigtigt at tage sikkerhedsforanstaltninger, når man arbejder med natrium.
Her er de vigtigste forskelle i reaktionerne mellem kalium og natrium med koldt vand:
- Reaktivitet: Kalium reagerer kraftigere med koldt vand sammenlignet med natrium.
- Varmeudvikling: Reaktionen af kalium med vand producerer mere varme end reaktionen af natrium med vand.
- Reaktionsrate: Reaktionen af kalium med vand forløber hurtigere end reaktionen af natrium med vand.
Det er vigtigt at bemærke, at både kalium og natrium er meget reaktive metaller og bør håndteres med forsigtighed. De bør altid opbevares i et tørt miljø og væk fra enhver fugtkilde for at forhindre utilsigtede reaktioner.
Sidste artikelEr positiv ladning spredt ligeligt over et atom?
Næste artikelDanner kalium og kobber en ionbinding?
 Varme artikler
Varme artikler
-
 Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print
Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print -
 Teamet bestemmer den første højopløselige struktur af dopaminreceptorenDenne illustration viser den kemiske arkitektur af aminosyrer, der udgør D4 -receptoren bundet til det antipsykotiske lægemiddel nemonaprid (pink). Kredit:UNC / UCSF På den ene eller anden måde, m
Teamet bestemmer den første højopløselige struktur af dopaminreceptorenDenne illustration viser den kemiske arkitektur af aminosyrer, der udgør D4 -receptoren bundet til det antipsykotiske lægemiddel nemonaprid (pink). Kredit:UNC / UCSF På den ene eller anden måde, m -
 Kunstigt blad som minifabrik til medicinSelv med det blotte øje er mængden af lys fanget af mini-fabrikkerne synlig, lyser knaldrødt. Venerne gennem bladene er de tynde kanaler, som væske kan pumpes igennem. Startprodukterne kommer ind i
Kunstigt blad som minifabrik til medicinSelv med det blotte øje er mængden af lys fanget af mini-fabrikkerne synlig, lyser knaldrødt. Venerne gennem bladene er de tynde kanaler, som væske kan pumpes igennem. Startprodukterne kommer ind i -
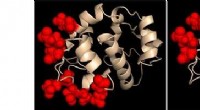 Forskere opdager, hvordan proteinpar styrer cellulære calciumsignalerProteinkemikers skildring af den calciumfølende region i to konstruerede STIM1-proteinvarianter. De steder, der blev ændret, er fremhævet i hvert tilfælde som røde kugler. Adfærden af disse to konst
Forskere opdager, hvordan proteinpar styrer cellulære calciumsignalerProteinkemikers skildring af den calciumfølende region i to konstruerede STIM1-proteinvarianter. De steder, der blev ændret, er fremhævet i hvert tilfælde som røde kugler. Adfærden af disse to konst
- Forskere trækker sig tilbage mod Harvards rumfartøjsteori
- Afdække, hvordan HIV samler sin lipidpels, som gør det muligt for den at trænge ind i celler
- Fords elektriske drev genopfinder den historiske Michigan-fabrik
- Ny nanoreaktor øger ydeevnen af elektrokemisk hydrogenudviklingsreaktion
- Tidlige data peger på sprudlende feriesalg i USA
- Forskere forbedrer en algoritme til røntgenfluorescensanalyse


