Hvorfor er gasser mindre tætte end faste stoffer og væsker?
Der er et par grunde til, at gasser er mindre tætte end faste stoffer og væsker. For det første bevæger partiklerne i en gas sig friere rundt end partiklerne i et fast stof eller en væske. Det betyder, at de kan sprede sig mere og fylde mere. For det andet er der mindre sandsynlighed for, at partiklerne i en gas hænger sammen end partiklerne i et fast stof eller en væske. Det betyder også, at de kan sprede sig mere og fylde mere.
Mængden af plads, som partiklerne i en gas fylder, påvirkes også af gassens temperatur. Jo højere temperatur, jo mere energi har partiklerne, og jo mere bevæger de sig rundt. Det betyder, at partiklerne vil sprede sig mere og gassen bliver mindre tæt.
En gass massefylde kan også påvirkes af gassens tryk. Jo højere tryk, jo mere presses partiklerne sammen, og jo tættere bliver gassen.
Sammenfattende er gasser mindre tætte end faste stoffer og væsker, fordi deres partikler er længere fra hinanden, og fordi de bevæger sig mere frit. En gass massefylde kan også påvirkes af gassens temperatur og tryk.
Sidste artikelHvad er pH af POP?
Næste artikelHvilke grundstoffer findes i forbindelsen HCl?
 Varme artikler
Varme artikler
-
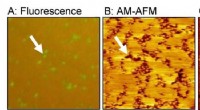 Samling af fluktuerende molekyler i kunstig cellemembranSe er lipiddobbeltlagsdomæner rige på polyethylenglycol (PEG)-modificeret lipid. (A) Fluorescensbillede, (B) amplitudemodulation (AM) AFM-topografi, og (C) frekvensmodulation (FM) AFM-topografi. Kredi
Samling af fluktuerende molekyler i kunstig cellemembranSe er lipiddobbeltlagsdomæner rige på polyethylenglycol (PEG)-modificeret lipid. (A) Fluorescensbillede, (B) amplitudemodulation (AM) AFM-topografi, og (C) frekvensmodulation (FM) AFM-topografi. Kredi -
 Brug af virtual reality-systemer til at undervise i kemi i 3-DEn abstrakt repræsentation af de fodboldformede buckminsterfulleren-molekyler i virtual reality. Kredit:Mike OConnor, i samarbejde med Interactive Scientific Ltd, under CC BY-ND 4.0. Et team af fo
Brug af virtual reality-systemer til at undervise i kemi i 3-DEn abstrakt repræsentation af de fodboldformede buckminsterfulleren-molekyler i virtual reality. Kredit:Mike OConnor, i samarbejde med Interactive Scientific Ltd, under CC BY-ND 4.0. Et team af fo -
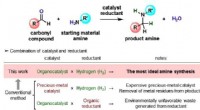 Nærmer sig en ideel aminosyresyntese ved hjælp af hydrogenFigur 1. Generelt skema for katalytisk reduktiv alkylering af aminer. Kredit:Osaka University Osaka Universitets forskere demonstrerede en reduktiv alkyleringsmetode til funktionalisering af subst
Nærmer sig en ideel aminosyresyntese ved hjælp af hydrogenFigur 1. Generelt skema for katalytisk reduktiv alkylering af aminer. Kredit:Osaka University Osaka Universitets forskere demonstrerede en reduktiv alkyleringsmetode til funktionalisering af subst -
 Bedre vurdering af bakteriers følsomhed over for antibiotika kan ændre, hvordan lægemidler ordine…En mikrochip-antibiotisk testplatform, der reducerer den nødvendige tid til at identificere den rigtige medicin, udviklet af forskere ved Korea Advanced Institute of Science and Technology. Kredit:Jeo
Bedre vurdering af bakteriers følsomhed over for antibiotika kan ændre, hvordan lægemidler ordine…En mikrochip-antibiotisk testplatform, der reducerer den nødvendige tid til at identificere den rigtige medicin, udviklet af forskere ved Korea Advanced Institute of Science and Technology. Kredit:Jeo
- Hvad bruges puderpulver til?
- Sådan beregnes middelværdien og variationen for en binomial fordeling
- Frontlinjekamp:Indonesien låst fast i en episk kamp mod junglen
- Halvdelen af vores kolleger lider af smerter og ubehag fra menstruation – men de er stadig et tabu…
- Team udvikler hurtig autentificeringsmetode for kinesisk medicin
- Fællesskab, natur- og 3-D-printere hjælper med at vække tidlig interesse for STEM


