Hvorfor er den metalliske binding i nogle metaller stærkere end bindinger i andre metaller?
1. Antal valenselektroner: Metaller med flere valenselektroner har en tendens til at have stærkere metalliske bindinger. Dette skyldes, at flere valenselektroner betyder flere elektroner, der kan delokaliseres og deles blandt de positivt ladede metalioner, hvilket øger den sammenhængende energi og bindingsstyrken. For eksempel har aluminium tre valenselektroner og en relativt stærk metallisk binding, mens natrium kun har en valenselektron og en svagere metallisk binding.
2. Atomstørrelse: Metaller med mindre atomradius har tendens til at have stærkere metalliske bindinger. Dette skyldes, at mindre atomer er tættere pakket sammen, hvilket giver mulighed for bedre overlapning mellem deres elektronorbitaler. Det øgede overlap fører til stærkere elektrostatisk tiltrækning og en mere stabil metallisk binding. For eksempel har jern en mindre atomradius og en stærkere metallisk binding end bly.
3. Krystalstruktur: Krystalstrukturen af et metal påvirker også styrken af dets metalliske binding. Metaller med en tætpakket krystalstruktur, såsom face-centered cubic (FCC) eller hexagonal close-packed (HCP), har stærkere metalliske bindinger end metaller med en kropscentreret kubisk (BCC) eller andre mindre tætpakkede strukturer. Dette skyldes, at tætpakkede strukturer muliggør mere effektiv pakning af atomer og bedre overlapning mellem elektronorbitaler. For eksempel har kobber en FCC-struktur og en stærk metallisk binding, mens chrom har en BCC-struktur og en svagere metallisk binding.
4. Ionisk karakter: Nogle metaller udviser delvis ionisk karakter i deres binding, hvilket kan påvirke styrken af den metalliske binding. Når forskellen i elektronegativitet mellem metalatomerne er signifikant, kan bindingen antage en vis ionisk karakter, hvor det ene atom fungerer som elektrondonor og det andet som elektronacceptor. Denne ioniske karakter kan svække den metalliske binding, da den reducerer antallet af delokaliserede elektroner og øger den elektrostatiske frastødning mellem de positivt ladede metalioner. For eksempel har calcium en let ionisk metallisk binding på grund af forskellen i elektronegativitet mellem calcium og de omgivende elektroner, hvilket svækker bindingen sammenlignet med en rent metallisk binding.
Sammenfattende er styrken af den metalliske binding i metaller bestemt af faktorer som antallet af valenselektroner, atomstørrelse, krystalstruktur og ionkarakter. Metaller med flere valenselektroner, mindre atomradius, tætpakkede krystalstrukturer og minimal ionkarakter har tendens til at have stærkere metalliske bindinger.
 Varme artikler
Varme artikler
-
 Levende celler integreret i fine strukturer skabt i en 3D-printerCeller, der breder sig i et 3D-stillads-fra venstre mod højre:uge 1, uge 3 uge 5. Top:3D-opsætning, bund:kun et lag. Kredit:Vienna University of Technology Vævsvækst og cellers adfærd kan kontroll
Levende celler integreret i fine strukturer skabt i en 3D-printerCeller, der breder sig i et 3D-stillads-fra venstre mod højre:uge 1, uge 3 uge 5. Top:3D-opsætning, bund:kun et lag. Kredit:Vienna University of Technology Vævsvækst og cellers adfærd kan kontroll -
 Forskere studerer den historiske udvikling af det periodiske system af kemiske grundstofferKemisk rum og det periodiske system af kemiske grundstoffer. Kredit:Thomas Endler / Max Planck Institute for Mathematics in the Sciences I 1860erne præsenterede kemikerne, Lothar Meyer og Dmitri Me
Forskere studerer den historiske udvikling af det periodiske system af kemiske grundstofferKemisk rum og det periodiske system af kemiske grundstoffer. Kredit:Thomas Endler / Max Planck Institute for Mathematics in the Sciences I 1860erne præsenterede kemikerne, Lothar Meyer og Dmitri Me -
 Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da -
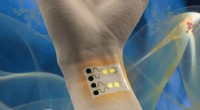 En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
- Virgin Galactic kontakter Boeings datterselskab for at bygge moderskibe
- Tsunamier kan koste strandturisme hundredvis af millioner af dollars hvert år
- Begivenheder med ultrahøj energi er nøglen til undersøgelse af spøgelsespartikler
- Hvordan man skriver kvadratiske ligninger givet et vertex og punkt
- Ørkenerne Renewable Resources
- Forskere udvikler en bedre metode til at fjerne giftige farvestoffer fra spildevand


