Hvad er forholdet mellem metallisk bindingsstyrke og fordampningsentalpi?
Metallisk binding er en type kemisk binding, der opstår mellem metalatomer. Det er forårsaget af tiltrækningen mellem de positivt ladede metalioner og det negativt ladede hav af elektroner, der omgiver dem. Styrken af den metalliske binding afhænger af antallet af valenselektroner, som metalatomerne har. Jo flere valenselektroner et metalatom har, jo stærkere vil den metalliske binding være.
Entalpi af fordampning er den mængde energi, der kræves for at fordampe et mol af et stof. Det er et mål for styrken af de intermolekylære kræfter mellem et stofs molekyler. Jo stærkere de intermolekylære kræfter er, jo højere vil fordampningsentalpien være.
I tilfælde af metaller er de intermolekylære kræfter de metalliske bindinger. Jo stærkere de metalliske bindinger er, jo højere vil fordampningsentalpien være. Dette skyldes, at det kræver mere energi at bryde de metalliske bindinger og fordampe metallet.
Følgende tabel viser forholdet mellem metallisk bindingsstyrke og fordampningsentalpi for nogle almindelige metaller:
| Metal | Metallisk bindingsstyrke (kJ/mol) | Fordampningsentalpi (kJ/mol) |
|---|---|---|
| Lithium | 105 | 162 |
| Natrium | 113 | 180 |
| Kalium | 98 | 129 |
| Calcium | 191 | 154 |
| Magnesium | 150 | 136 |
| Aluminium | 326 | 294 |
Som du kan se i tabellen, har metallerne med de stærkeste metalliske bindinger også de højeste fordampningsentalpier. Dette viser, at der er en direkte sammenhæng mellem metallisk bindingsstyrke og fordampningsentalpi.
 Varme artikler
Varme artikler
-
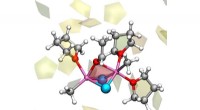 Den 120 år gamle kolde sag for Grignard-reaktionen er endelig løstDet reaktive kompleks af Grignard-reaktionen, involverer to molekyler af Grignard-reagens CH3MgCl, der interagerer med acetaldehyd, og med tre molekyler tetrahydrofuran-ether. Andre opløsningsmiddelmo
Den 120 år gamle kolde sag for Grignard-reaktionen er endelig løstDet reaktive kompleks af Grignard-reaktionen, involverer to molekyler af Grignard-reagens CH3MgCl, der interagerer med acetaldehyd, og med tre molekyler tetrahydrofuran-ether. Andre opløsningsmiddelmo -
 Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print
Ny inkjet-udskrivningsmetode kunne fremskynde opdagelse af lægemidler og trykt personlig lægemidde…Tomme porer synlige i en polymerfilm, hvor dråber blev trykt, fanget og frigivet. Kredit:University of Cambridge Cambridge-ingeniører har demonstreret - for første gang - den digitale inkjet-print -
 Blåt lys betyder store fremskridt for perovskit-baserede LED'erForskere ved Linköpings Universitet, Sverige, har udviklet effektive blå lysemitterende dioder baseret på halogenidperovskitter. Kredit:Thor Balkhed Forskere ved Linköpings Universitet, Sverige, h
Blåt lys betyder store fremskridt for perovskit-baserede LED'erForskere ved Linköpings Universitet, Sverige, har udviklet effektive blå lysemitterende dioder baseret på halogenidperovskitter. Kredit:Thor Balkhed Forskere ved Linköpings Universitet, Sverige, h -
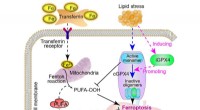 Målretning mod en ny inducerbar isoform til behandling af metabolisk-associeret fedtleversygdomGrafisk abstrakt. Kredit:Acta Pharmaceutica Sinica B (2022). DOI:10.1016/j.apsb.2022.02.003 Metabolisk associeret fedtleversygdom (MAFLD), som tidligere var kendt som ikke-alkoholisk fedtleversygdo
Målretning mod en ny inducerbar isoform til behandling af metabolisk-associeret fedtleversygdomGrafisk abstrakt. Kredit:Acta Pharmaceutica Sinica B (2022). DOI:10.1016/j.apsb.2022.02.003 Metabolisk associeret fedtleversygdom (MAFLD), som tidligere var kendt som ikke-alkoholisk fedtleversygdo
- Traumer og børn:Den tidlige barndomslærers rolle
- Amerikanske fattigdomsstatistikker ignorerer millioner af kæmpende amerikanere
- Undersøgelse analyserer fordelene ved sporingsenheder til bilforsikring
- Apple og Johnson &Johnson går sammen om undersøgelse for at reducere risikoen for slagtilfælde:Så…
- Små partikler med en stor, cool rolle at spille i mikroskopi
- Forskere viser, at når det kommer til klimaændringer og vandløb, spiller planter en vigtig rolle


