Hvorfor ændrer indikatorer i kemi farve, når de placeres forskellige stoffer?
Den specifikke farveændring, som en indikator gennemgår, afhænger af typen af indikator og det stof, den reagerer med. For eksempel er phenolphtalein en indikator, der bliver lyserød i nærvær af en base. Dette skyldes, at hydroxidionerne i basen reagerer med phenolphtalein-molekylet og danner en ny forbindelse, der er lyserød i farven.
Andre indikatorer, såsom lakmus, ændrer farve i nærvær af både syrer og baser. Lakmus bliver rød i nærvær af en syre og blå i nærvær af en base. Dette skyldes, at hydrogenionerne i en syre reagerer med lakmusmolekylet og danner en ny forbindelse, der er rød i farven, mens hydroxidionerne i en base reagerer med lakmusmolekylet og danner en ny forbindelse, der er blå i farven.
Indikatorernes evne til at ændre farve gør dem til et værdifuldt værktøj inden for kemi. De kan bruges til at identificere tilstedeværelsen af syrer og baser og til at bestemme pH-værdien af en opløsning.
 Varme artikler
Varme artikler
-
 3-D-billeder af stofsandwich kan hjælpe med at måle tekstilfriktionEt vævet stofoverfladeanalysebillede taget fra Xradia 510 Versa 3D XRM-CT placeret på NC State Analytical Instrumentation Facility. Kredit:Ruksana Baby For at kvantificere præcis, hvor kløende en
3-D-billeder af stofsandwich kan hjælpe med at måle tekstilfriktionEt vævet stofoverfladeanalysebillede taget fra Xradia 510 Versa 3D XRM-CT placeret på NC State Analytical Instrumentation Facility. Kredit:Ruksana Baby For at kvantificere præcis, hvor kløende en -
 Fleksibel kvantesigte filtrerer brændstoffet fra rumskib EnterpriseKun deuterium kan åbne porerne i DUT-8, mens brint efterlader rammen lukket. Denne meget selektive detektion fører til en høj separationsselektivitet kombineret med høj deuteriumoptagelse. Kredit:Dr.
Fleksibel kvantesigte filtrerer brændstoffet fra rumskib EnterpriseKun deuterium kan åbne porerne i DUT-8, mens brint efterlader rammen lukket. Denne meget selektive detektion fører til en høj separationsselektivitet kombineret med høj deuteriumoptagelse. Kredit:Dr. -
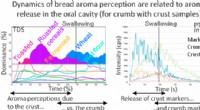 Hvorfor en sprækkelig skorpe er afgørende for en baguettes aroma og smagKredit:American Chemical Society En autentisk fransk baguette er en af de vigtigste råvarer, som foodies jagter efter. Nu har forskere fået ny indsigt i, hvorfor en sprød skorpe er et must til d
Hvorfor en sprækkelig skorpe er afgørende for en baguettes aroma og smagKredit:American Chemical Society En autentisk fransk baguette er en af de vigtigste råvarer, som foodies jagter efter. Nu har forskere fået ny indsigt i, hvorfor en sprød skorpe er et must til d -
 Skinner lys for at lave brintD. desulfuricans-CdS hybrider udviser høj H2 produktionsaktivitet, høj stabilitet og en bemærkelsesværdig effektivitet ved direkte brug af solenergi. Kredit:Inês Cardoso Pereira; Mónica Martins De
Skinner lys for at lave brintD. desulfuricans-CdS hybrider udviser høj H2 produktionsaktivitet, høj stabilitet og en bemærkelsesværdig effektivitet ved direkte brug af solenergi. Kredit:Inês Cardoso Pereira; Mónica Martins De
- Hvem skal holdes ansvarlig for Aliso Canyon gaslækage?
- Tyskland returnerer gravplyndrede genstande til Alaska
- Udtalelse:Jeg vil gerne beskytte mit barn mod misbrug - men forskning fortæller mig, at jeg gør de…
- De olympiske tv-stationer forbereder sig på det største show i verden
- Verdens søer mister hurtigt ilt, når planeten opvarmes
- WOW Air søger gældssanering, da Icelandair stopper forhandlingerne


