Hvor mange kemiske bindinger kan et enkelt atom af disse grundstoffer danne brint carbon nitrogen?
Hydrogenatom har en elektron i den yderste skal, som kan danne en kovalent binding med et andet atom for at opnå stabilitet. For eksempel, i tilfælde af vand (H2O), danner hvert brintatom én binding med oxygen.
Kulstof
Et enkelt carbonatom kan maksimalt danne fire kovalente bindinger. Denne alsidighed skyldes kulstoffets fire valenselektroner, som gør det muligt for det at dele elektronpar med op til fire andre atomer. For eksempel i metan (CH4) deler kulstof sine fire valenselektroner med fire hydrogenatomer, der danner fire kovalente CH-bindinger.
Nitrogen
Nitrogen har fem valenselektroner og kan typisk danne tre kovalente bindinger. Ved at dele tre elektronpar med andre atomer opnår nitrogen en stabil konfiguration. For eksempel i ammoniak (NH3) danner hvert nitrogenstof tre bindinger med tre hydrogenatomer. Imidlertid kan nitrogen lejlighedsvis danne fire eller endda fem kovalente bindinger under specifikke forhold.
 Varme artikler
Varme artikler
-
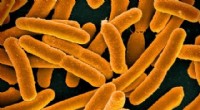 Forskere skaber genvej til terpenbiosyntese i E. coliE coli. Kredit:North Carolina State University Forskere fra North Carolina State University har udviklet en kunstig enzymatisk vej til syntetisering af isoprenoider, eller terpener, i E coli . D
Forskere skaber genvej til terpenbiosyntese i E. coliE coli. Kredit:North Carolina State University Forskere fra North Carolina State University har udviklet en kunstig enzymatisk vej til syntetisering af isoprenoider, eller terpener, i E coli . D -
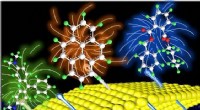 Ny Raman-metode fanger målmolekyler i små huller aktivtSkematisk diagram af princippet om den generelle overfladeforstærkede Raman-spektroskopimetode til aktivt at fange målmolekyler i små huller med opløsningsmidlet. Kredit:GE Meihong For nylig, Prof
Ny Raman-metode fanger målmolekyler i små huller aktivtSkematisk diagram af princippet om den generelle overfladeforstærkede Raman-spektroskopimetode til aktivt at fange målmolekyler i små huller med opløsningsmidlet. Kredit:GE Meihong For nylig, Prof -
 Sådan optimerer du processen med polymerekstruderingKredit:Pixabay/CC0 Public Domain Ekstrusion er en proces, der er meget udbredt i polymerforarbejdningsindustrien. Det involverer at skubbe materiale gennem en matrice med en bestemt tværsnitsform,
Sådan optimerer du processen med polymerekstruderingKredit:Pixabay/CC0 Public Domain Ekstrusion er en proces, der er meget udbredt i polymerforarbejdningsindustrien. Det involverer at skubbe materiale gennem en matrice med en bestemt tværsnitsform, -
 Tre forskere vinder Nobelprisen i kemi for udviklingen inden for elektronmikroskopiEn revolutionerende teknik kaldet kryo-elektronmikroskopi, som har set nærmere på Zika -viruset og et Alzheimers enzym, tjente forskere Jacques Dubochet, Joachim Frank og Richard Henderson Nobels kemi
Tre forskere vinder Nobelprisen i kemi for udviklingen inden for elektronmikroskopiEn revolutionerende teknik kaldet kryo-elektronmikroskopi, som har set nærmere på Zika -viruset og et Alzheimers enzym, tjente forskere Jacques Dubochet, Joachim Frank og Richard Henderson Nobels kemi
- Incivility på arbejdet:bliver 'dronningbi-syndrom' værre?
- Blysikkerhedsvejledning mangler for bybønder i mange større amerikanske byer
- Internet of Things har brug for ultrakompakte superkondensatorer
- Forbedring af effektiviteten af systemer til tidlig varsling om jordskælv
- Holografi og kritik i matchgate-tensor-netværk
- Sådan fungerer supermåner


