Nævn 3 stærke syrer og forklar hvorfor disse betragtes som syrer?
* Hvorfor er det en syre: HCl dissocierer fuldstændigt i vand og frigiver H+ ioner. Jo højere koncentrationen af H+ ioner er, jo stærkere er syren. HCl har en meget høj dissociationskonstant (Ka) på 1 x 10^7, hvilket betyder, at den donerer protoner meget let.
2. Svovlsyre (H2SO4)
* Hvorfor er det en syre: H2SO4 er en diprotisk syre, hvilket betyder, at den kan donere to protoner pr. molekyle. Det dissocierer i vand og danner H+-ioner og HSO4-ioner. Den første dissociation er meget stærk med en Ka på 1 x 10^2, mens den anden dissociation er svagere med en Ka på 1 x 10^-2.
3. Salpetersyre (HNO3)
* Hvorfor er det en syre: HNO3 er en stærk syre, der dissocierer fuldstændigt i vand og frigiver H+ ioner og NO3- ioner. Den har en meget høj Ka på 1 x 10^6.
Yderligere bemærkninger :
* Alle disse syrer er ætsende på hud og væv.
* Stærke syrer kan reagere med metaller og danne brændbar brintgas.
* Stærke syrer skal altid håndteres med forsigtighed og passende beskyttelsesudstyr.
Sidste artikelHvorfor skal kemiske ligninger balanceres?
Næste artikelHvilken blanding er mest sandsynlig en løsning?
 Varme artikler
Varme artikler
-
 Ny undersøgelse hjælper med at karakterisere sammensmeltning af metallerEn prøve af Niob i mikroskopisk størrelse mellem to diamanter. Kredit:Asociación RUVID I de seneste år, en stor indsats er blevet afsat til undersøgelse af smeltningskurven for elementer ved højt
Ny undersøgelse hjælper med at karakterisere sammensmeltning af metallerEn prøve af Niob i mikroskopisk størrelse mellem to diamanter. Kredit:Asociación RUVID I de seneste år, en stor indsats er blevet afsat til undersøgelse af smeltningskurven for elementer ved højt -
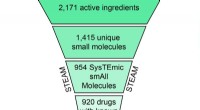 EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d
EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d -
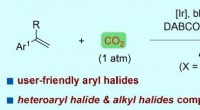 Synligt lys-drevet arylcarboxylering af styrener med kuldioxid og arylhalogeniderFigur:Synligt lys-drevet arylcarboxylering af styrener med CO2 og arylhalogenider. Kredit:Prof. LIs gruppe Brugen af kuldioxid (CO 2 ), som er en ideel one-carbon (C1) byggesten og er bæredygt
Synligt lys-drevet arylcarboxylering af styrener med kuldioxid og arylhalogeniderFigur:Synligt lys-drevet arylcarboxylering af styrener med CO2 og arylhalogenider. Kredit:Prof. LIs gruppe Brugen af kuldioxid (CO 2 ), som er en ideel one-carbon (C1) byggesten og er bæredygt -
 Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi
Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi
- Model til 2-D materialebaseret RRAM fundet
- Hvorfor vand skal være kernen i klimaindsatsen
- En big data-platform til at tage EU's syv samfundsudfordringer op
- For at fremme menneskerettighederne, konsultere neurovidenskab
- Elon Musk præsenterer underjordisk LA-tunnelprojekt
- Cellulær mikroRNA-detektion med mirakler


